近日,石藥集團產品管線動態(tài)頻頻:雙抗NBL-028首次申請臨床、拿下抗抑郁藥首仿......今年以來,石藥集團有6個品種獲批生產并視同過評(2個為首仿),mRNA疫苗產品獲緊急授權使用。目前公司有58款1類新藥處于申請臨床及以上階段,其中有9款已步入III期臨床或NDA階段;96個品種過評(26個為首家),18個新分類申報品種在審,其中8個暫無首仿獲批(含劑型首仿)。
拿下2大重磅首仿!96個過評品種亮眼
7月4日,國家藥監(jiān)局官網顯示,石藥集團歐意藥業(yè)申報的3類仿制藥琥珀酸地文拉法辛緩釋片(琥珀酸去甲文拉法辛緩釋片)獲批生產,為國內首仿+首家過評。這是一款選擇性5-羥色胺-去甲腎上腺素再攝取抑制劑,為第三代抗抑郁藥。
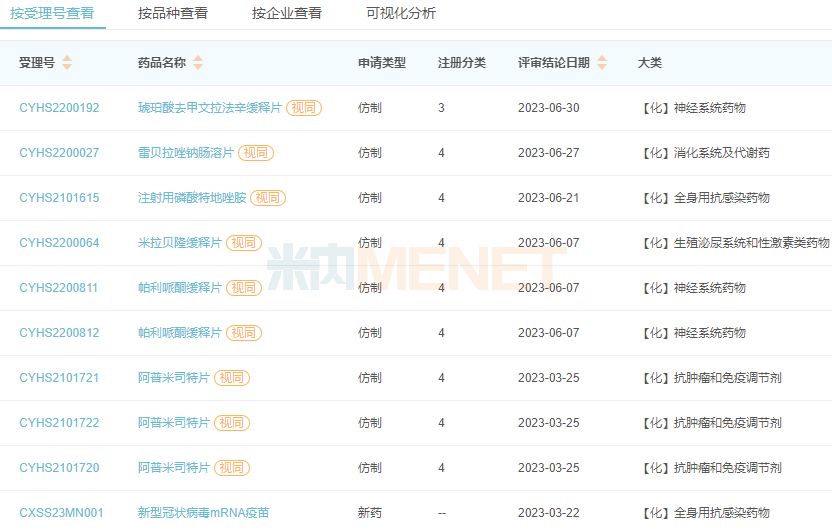
以審評結論日期計,今年以來,石藥集團有6個品種獲批生產并視同過評,涵蓋神經系統(tǒng)、全身用抗感染、抗腫瘤和免疫調節(jié)劑等多個治療領域;此外,新型冠狀病毒mRNA疫苗 (SYS6006) 納入緊急使用,是國內首個自主研發(fā),獲得緊急授權使用的mRNA疫苗產品。
2023年至今石藥集團獲批上市的產品
來源:米內網中國申報進度(MED)數(shù)據(jù)庫
6個仿制藥中,琥珀酸地文拉法辛緩釋片、阿普米司特片為國內首仿+首家過評,其中阿普米司特2022年全球銷售額超過22億美元;帕利哌酮緩釋片國產第2家獲批,米拉貝隆緩釋片國產第4家獲批。
截至目前,石藥集團已有96個品種過評/視同過評,其中26個為首家過評,琥珀酸去甲文拉法辛緩釋片、鹽酸決奈達隆片、瑪巴洛沙韋片、注射用兩性霉素B膽固醇硫酸酯復合物、雙嘧達莫片、格列美脲分散片、頭孢羥氨芐片、鹽酸雷尼替丁膠囊等9個品種獨家過評。
石藥集團過評情況
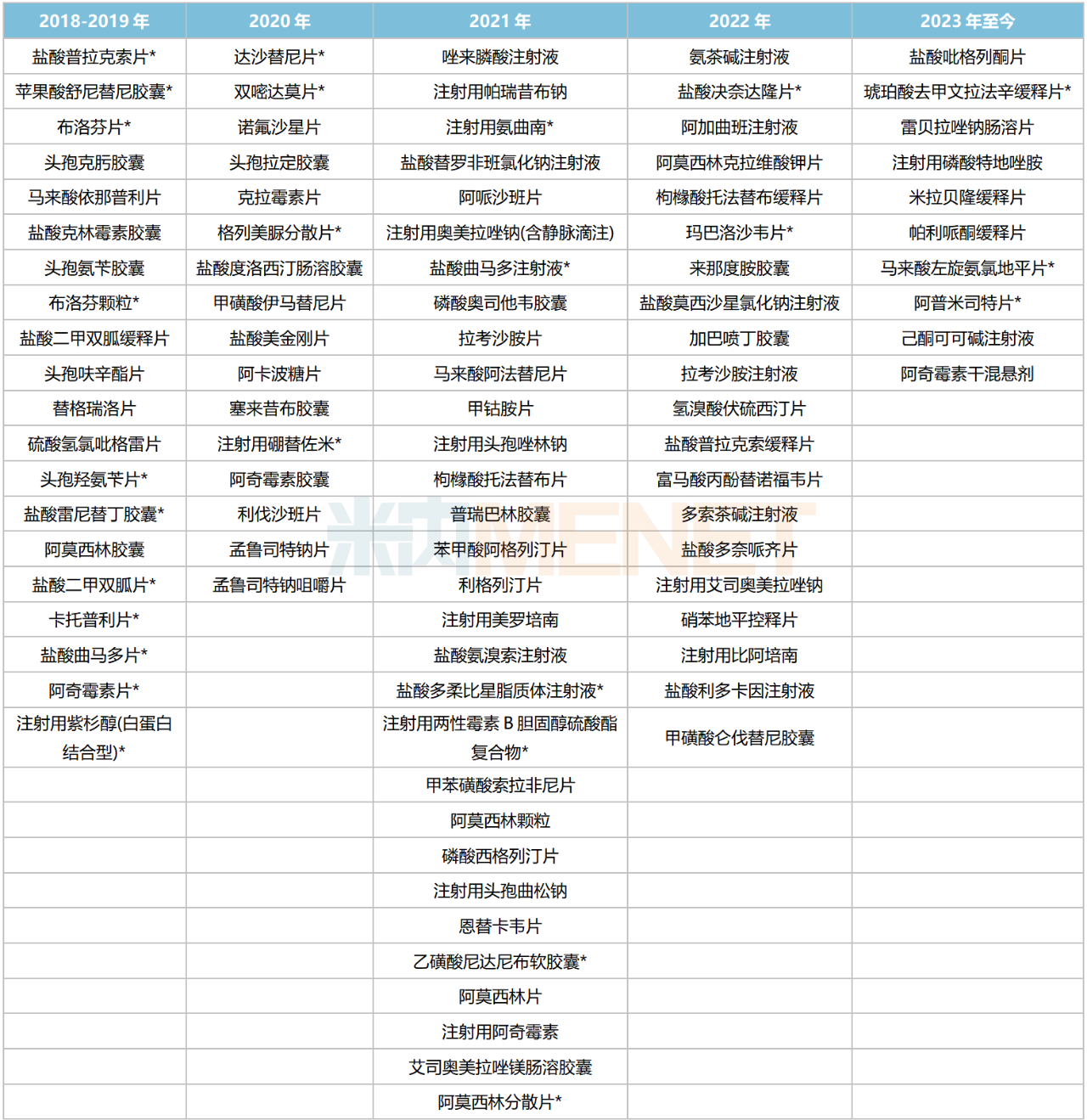
注:帶*為首家/獨家過評
來源:米內網中國申報進度(MED)數(shù)據(jù)庫
在目前開展的七批八輪化藥集采中,石藥集團分別有1個、3個、8個、6個、3個、9個、2個品種中標,合計32個品種,為國家集采頭部供應商之一。
在即將啟動的第九批集采,石藥集團有10余個過評品種已滿足5家及以上的充分競爭條件,包括西格列汀口服常釋劑型、阿格列汀口服常釋劑型、來那度胺口服常釋劑型、特地唑胺注射劑、雷貝拉唑口服常釋劑型、伏硫西汀口服常釋劑型、阿奇霉素口服液體劑、利格列汀口服常釋劑型、拉考沙胺注射劑、阿普米司特口服常釋劑型、米拉貝隆緩釋控釋劑型、托法替布緩釋控釋劑型等。
58款1類新藥在路上,猛攻雙抗、ADC......
研發(fā)創(chuàng)新是石藥集團的核心驅動力,近年來公司持續(xù)加大研發(fā)投入,2022年研發(fā)費用達39.87億元,同比增長16.1%,約占成藥業(yè)務收入16.3%。在高強度的研發(fā)投入下,石藥集團打造了豐富的產品管線,目前在研創(chuàng)新藥項目110余個,其中大分子約40個、小分子約40個、新型制劑約30個。
今年以來,石藥集團新藥研發(fā)進展不斷:1類新藥巴托利單抗注射液(HBM9161注射液)、普盧格列汀片、恩朗蘇拜單抗注射液以及3.3類新藥奧馬珠單抗生物類似藥申報上市;國內首款抗GFRAL單抗JMT203、ATM抑制劑SYH2051、PRMT5抑制劑SYH2045等首次獲批臨床。
此外,石藥集團在創(chuàng)新藥出海方面也迎來重大進展。6月12日,石藥集團宣布,公司開發(fā)的同類首創(chuàng)ADC藥物CPO301獲得FDA授予快速通道資格,該產品于今年4月在美國獲批臨床;2月13日,集團附屬公司石藥巨石生物的SYS6002(Nectin-4 ADC)授權給美國Corbus,最高金額達6.925億美元。
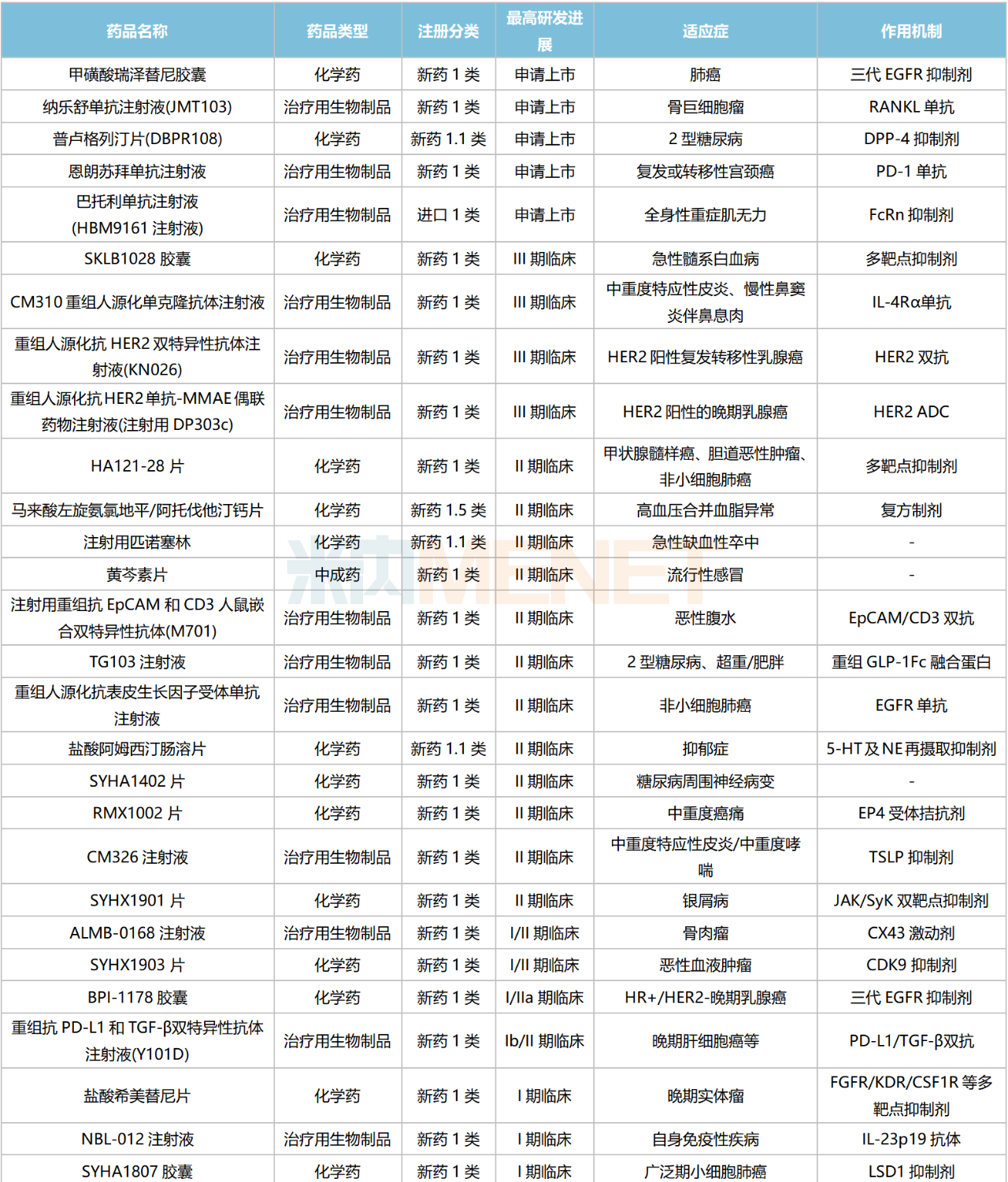
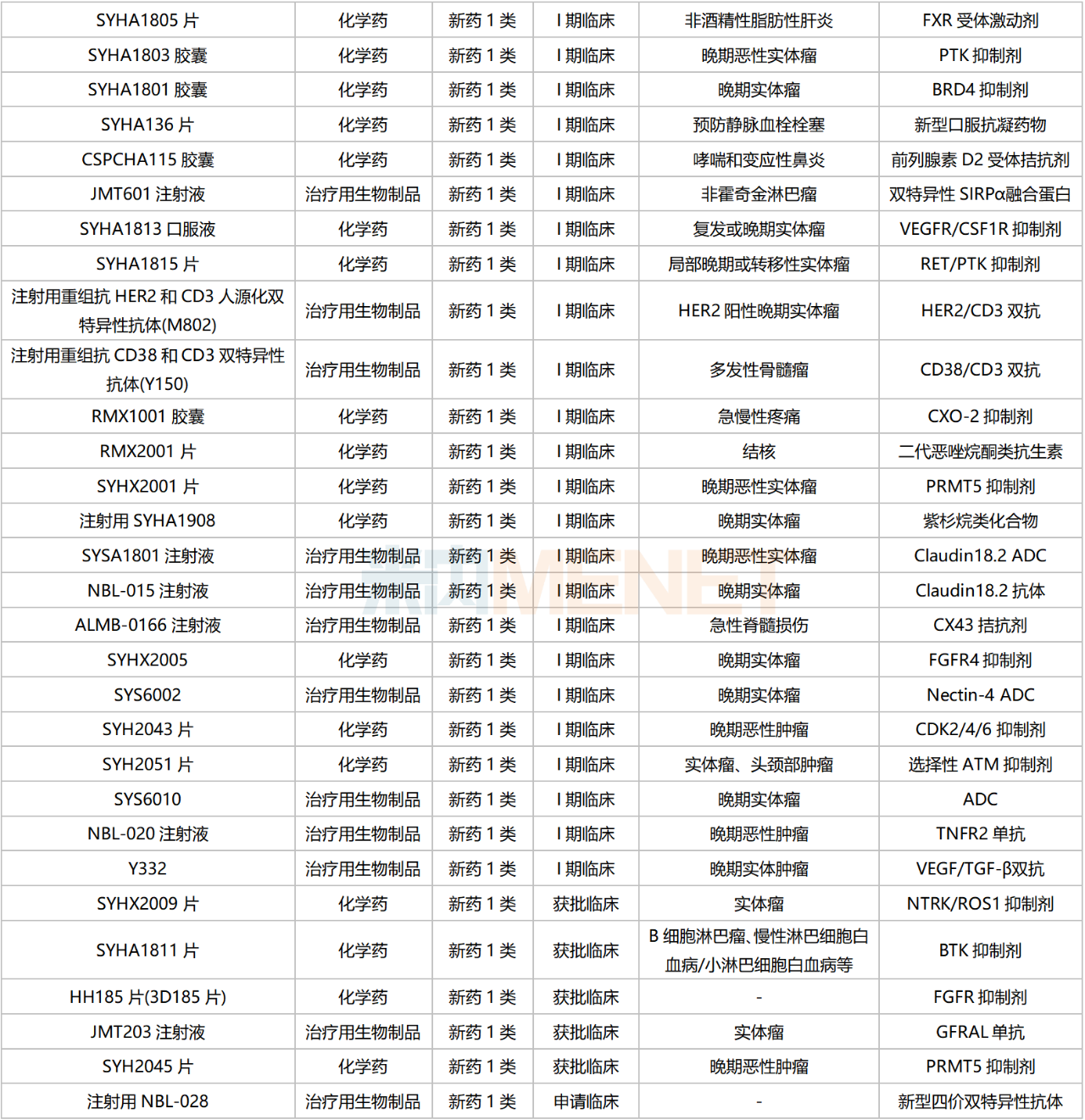
含合作引進的產品在內,目前石藥集團有58款1類新藥(不含已上市新藥及新增適應癥)在國內處于申請臨床及以上階段,集中在抗腫瘤藥領域,消化系統(tǒng)、心腦血管系統(tǒng)、呼吸系統(tǒng)、神經系統(tǒng)等也有所涉及。從作用機制看,化學藥以多靶點抑制劑為主,生物藥涵蓋單抗、雙抗、ADC藥物等。
石藥集團國內在研1類新藥
來源:米內網綜合數(shù)據(jù)庫
5款1類新藥已申報上市。其中,納樂舒單抗(JMT103)是首款報產的國產RANKL抗體新藥,國內已獲批上市的同靶點藥物為安進的地舒單抗,該產品2022全球銷售額超過50億美元;巴托利單抗(HBM9161)屬于FcRn抑制劑,國內同靶點獲批藥物為安進/再鼎的艾加莫德α,該產品于今年6月獲批進口。
4款1類新藥已步入III期臨床。其中,CM310重組人源化單克隆抗體屬于IL-4R單抗,國內已獲批的同靶點藥物為賽諾菲的度普利尤單抗(2020年6月),該產品2022年在中國三大終端六大市場的銷售額接近13億元,同比增長166%;KN026為HER2雙抗,目前石藥集團有7款雙抗藥物處于申請臨床及以上階段,涉及EpCAM、CD3、PD-L1、TGF-β、HER2、CD38等靶點;DP303c為HER2 ADC,目前公司有4款ADC藥物步入臨床試驗階段,涉及HER2、Claudin18.2、Nectin-4等靶點。
18個新品沖刺上市,9大品種搶首仿
除了1類新藥,石藥集團還有10余個改良新藥/生物類似藥處于申請臨床及以上階段。
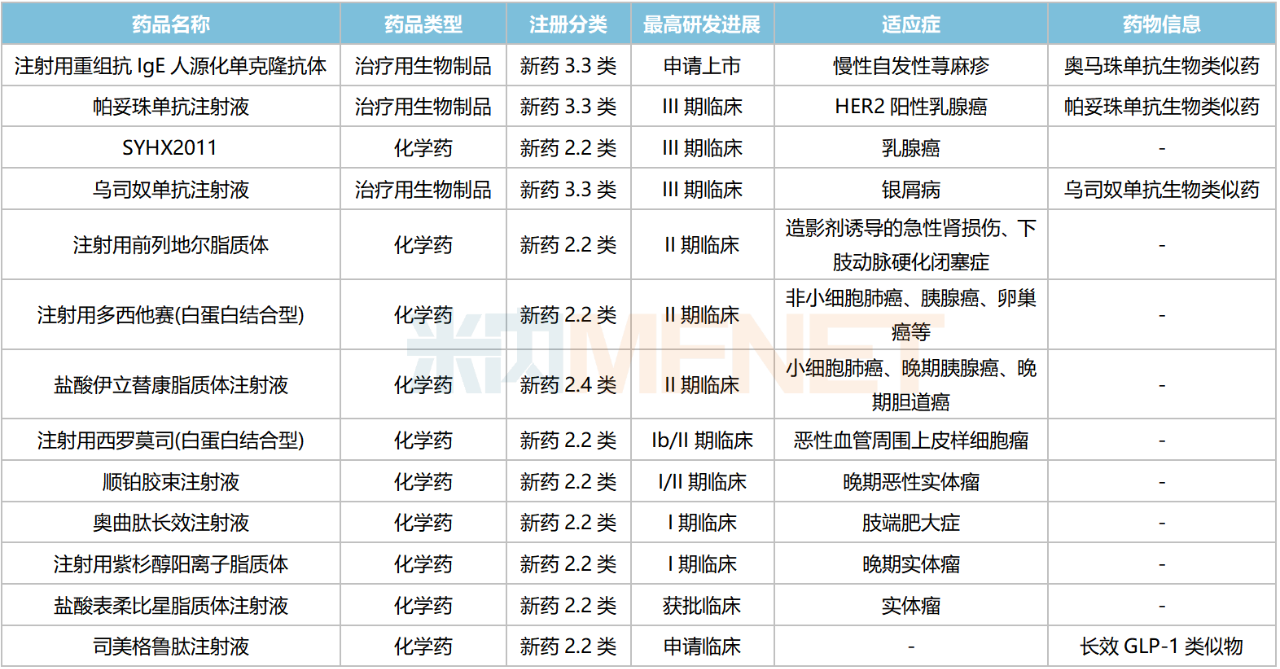
石藥集團部分在研的改良新藥及生物類似藥
來源:米內網綜合數(shù)據(jù)庫
奧馬珠單抗已申報上市,原研產品2022年全球銷售額超過35億美元;帕妥珠單抗處于III期臨床,該產品在國內暫無生物類似藥獲批,原研產品2022年在中國三大終端六大市場的銷售額超過35億元,同比增長14.3%。
注射用前列地爾脂質體、注射用多西他賽(白蛋白結合型)、鹽酸伊立替康脂質體注射液正在開展II期臨床。米內網數(shù)據(jù)顯示,前列地爾、多西他賽在中國公立醫(yī)療機構終端的銷售峰值分別超過70億元、40億元。
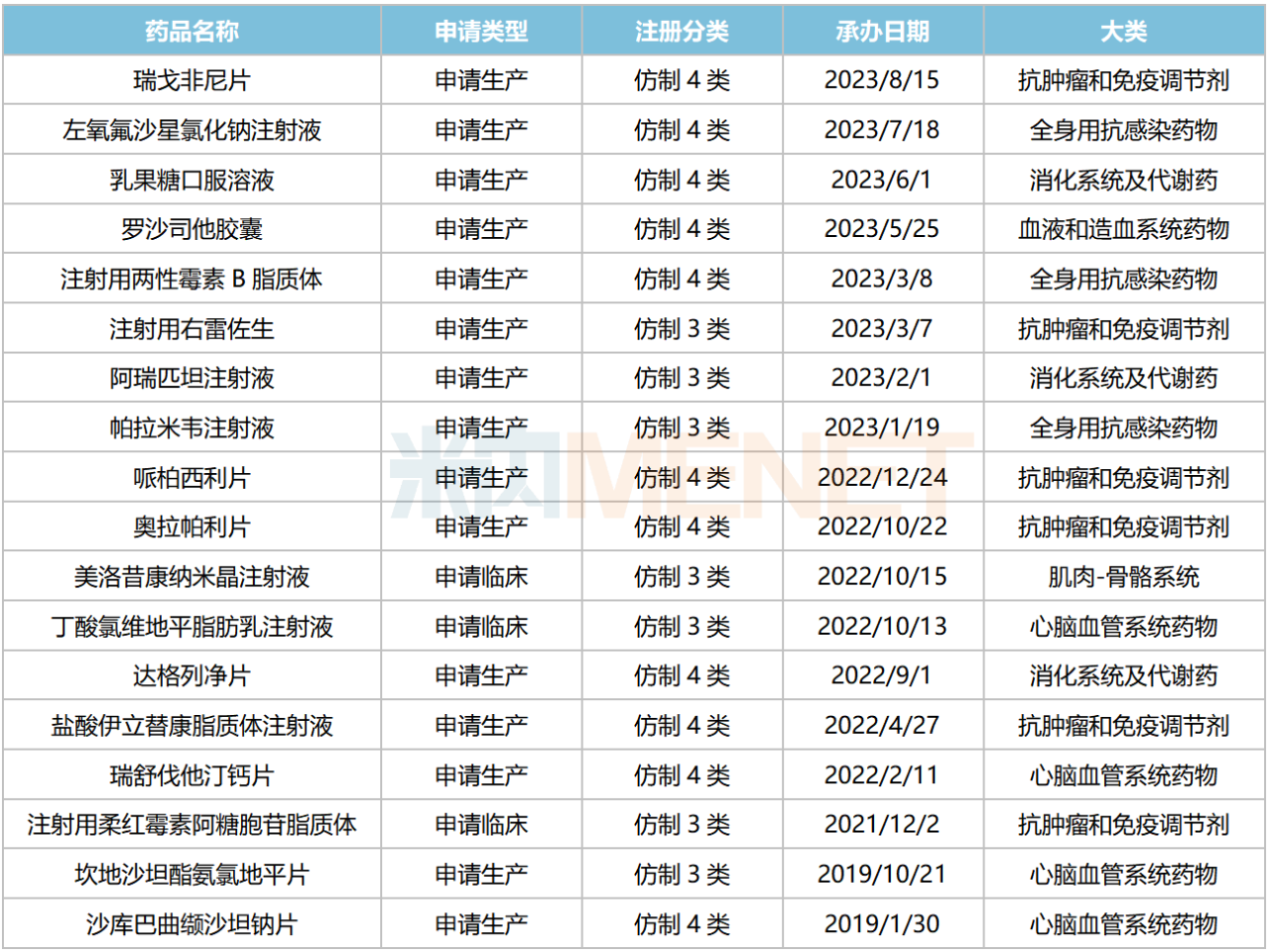
在仿制藥方面,今年以來,石藥集團有8個品種以新注冊分類報產。截至目前,公司有18個新分類申報的品種在審,其中有8個暫無首仿(含劑型首仿)獲批上市,包括羅沙司他膠囊、哌柏西利片、美洛昔康納米晶注射液、丁酸氯維地平脂肪乳注射液、鹽酸伊立替康脂質體注射液、注射用柔紅霉素阿糖胞苷脂質體、坎地沙坦酯氨氯地平片、沙庫巴曲纈沙坦鈉片等。
石藥集團新分類申報且在審的品種
來源:米內網中國申報進度(MED)數(shù)據(jù)庫
3個品種由石藥集團獨家以新注冊分類申報。其中,注射用柔紅霉素阿糖胞苷脂質體、坎地沙坦酯氨氯地平片等品種在國內市場空白。
資料來源:米內網數(shù)據(jù)庫、公司公告等
注:米內網《中國三大終端六大市場藥品競爭格局》,統(tǒng)計范圍是:城市公立醫(yī)院和縣級公立醫(yī)院、城市社區(qū)中心和鄉(xiāng)鎮(zhèn)衛(wèi)生院、城市實體藥店和網上藥店,不含民營醫(yī)院、私人診所、村衛(wèi)生室,不含縣鄉(xiāng)村藥店;上述銷售額以產品在終端的平均零售價計算。數(shù)據(jù)統(tǒng)計截至8月16日,如有疏漏,歡迎指正!

