政策和資本雙重驅(qū)動下,我國創(chuàng)新藥產(chǎn)業(yè)近年在高速發(fā)展。與此同時,創(chuàng)新研發(fā)同質(zhì)化等問題也倒逼越來越多中國創(chuàng)新企業(yè)選擇出海、差異化路線。據(jù)不完全統(tǒng)計,2022年至今達(dá)成的License-out交易已超過70起,交易總金額合計超443億美元;科倫藥業(yè)、和黃藥業(yè)、康方生物等頭部藥企火力全開、頻頻刷新交易記錄,國產(chǎn)1類新藥成主力選手......License-out日趨火熱,解決產(chǎn)品同質(zhì)化、創(chuàng)新差異化、海外監(jiān)管規(guī)范化等五大要點,將成為中國創(chuàng)新藥企業(yè)打贏出海攻堅戰(zhàn)的關(guān)鍵。
近年來,隨著系列政策的大力推動,疊加國內(nèi)創(chuàng)新同質(zhì)化嚴(yán)重的背景下,不論是國內(nèi)傳統(tǒng)大藥企,還是Biotech新貴都紛紛踏上“創(chuàng)新轉(zhuǎn)型、揚帆出海”的新賽道,海外授權(quán)(License-out)數(shù)量與合作金額都在不斷攀升。
據(jù)不完全統(tǒng)計,我國2022年創(chuàng)新藥License-out交易至少發(fā)生了45起,披露的交易總金額約275.5億美元,是2021年的兩倍。2023年以來,國內(nèi)已發(fā)生至少28起License-out交易,與去年同期相比上漲58%,可統(tǒng)計的累計交易總金額超過173.6億美元......密集的出海交易正體現(xiàn)出中國創(chuàng)新藥企擺脫內(nèi)卷、完成商業(yè)閉環(huán)并走向更高格局的決心。
近年來License-out交易情況
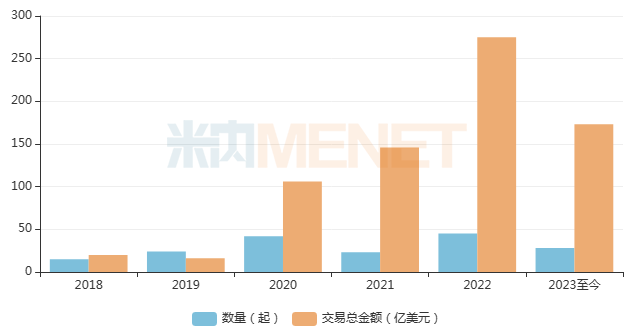
來源:公司公告、公開信息等,米內(nèi)網(wǎng)整理
$270億創(chuàng)紀(jì)錄!科倫、康方、石藥......頻秀“肌肉”
過去的2022年,共有45個項目達(dá)成出海交易。從轉(zhuǎn)讓企業(yè)端看,科倫藥業(yè)、信達(dá)生物、君實生物、華東醫(yī)藥、石藥集團、先聲藥業(yè)、康方生物、綠葉制藥等多家本土藥企上榜;受讓端也不乏默沙東、輝瑞、賽諾菲、阿斯利康、雅培、楊森制藥等知名跨國藥企。
2022年創(chuàng)新藥出海情況

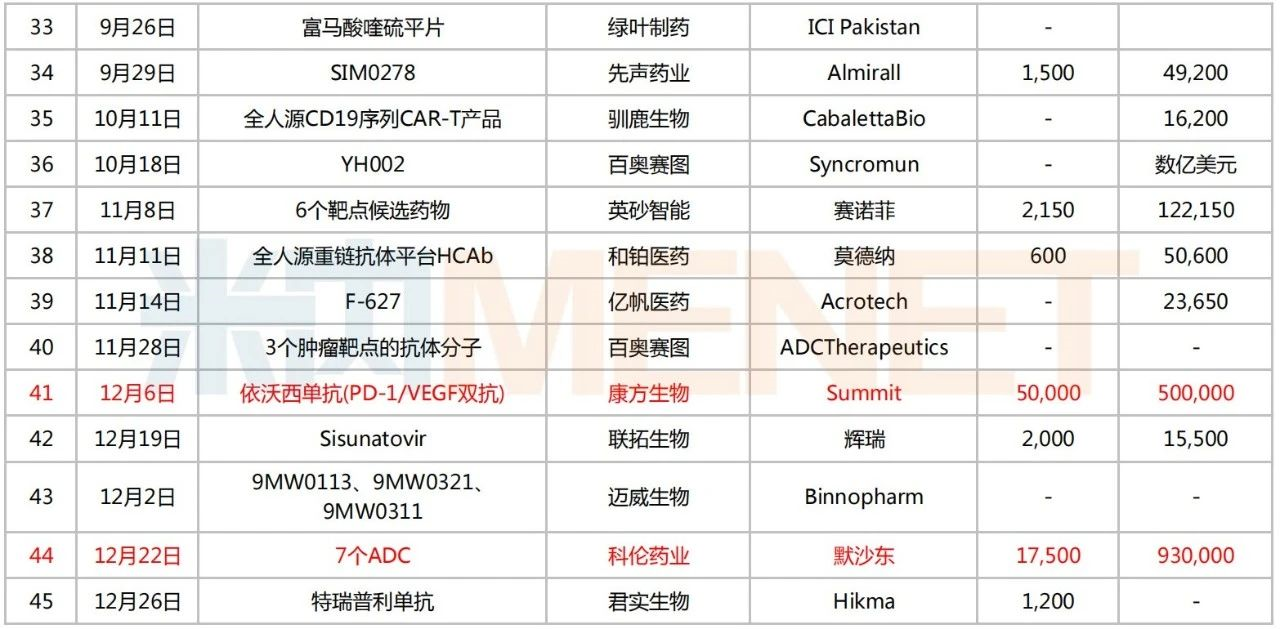
注:標(biāo)紅為交易總金額超25億美元
來源:公司公告等,米內(nèi)網(wǎng)整理
值得一提的是,科倫藥業(yè)的控股子公司科倫博泰于今年7月登陸港交所,IPO凈額超12億港元。而備受矚目的是其2022年三次牽手默沙東,完成合計總金額超110億美元的9項ADC項目授權(quán)交易,再度刷新國內(nèi)License-out總金額交易紀(jì)錄,成為ADC授權(quán)出海的領(lǐng)航者。
作為一家全球獨角獸企業(yè),目前科倫博泰已建立33項資產(chǎn)的管線,包括2項核心ADC產(chǎn)品——KL-A166(HER2)及KL-A264(TROP2),其中前者已報產(chǎn)在審,后者已進入Ⅲ期臨床。
科倫博泰在研ADC情況(Ⅲ期臨床及以上)

來源:全球藥物研發(fā)數(shù)據(jù)庫
此外,康方生物于日前發(fā)布2023年半年業(yè)績預(yù)告,預(yù)計今年上半年將錄得凈利潤約23億元,這是公司首次實現(xiàn)半年度盈利??捣缴锉硎荆舜螌崿F(xiàn)半年度盈利,一是由于其核心產(chǎn)品依沃西單抗(PD-1/VEGF)對外授權(quán)(Summit)獲得約為29億元的巨額收入;二是其2款1類新藥卡度尼利單抗(PD-1/CTLA-4)、派安普利單抗(PD-1)持續(xù)放量實現(xiàn)銷售收入增長。
米內(nèi)網(wǎng)數(shù)據(jù)顯示,依沃西單抗(AK112)是一款潛在的全球首創(chuàng)雙特異性抗體,可同時阻斷PD-1和VEGF通路,在同靶點組合中為全球研發(fā)進度最快的藥物,目前已在國內(nèi)報產(chǎn)在審;而卡度尼利單抗、派安普利單抗商業(yè)化前景可觀,2022年在中國三大終端六大市場(統(tǒng)計范圍詳見本文末)銷售額分別超3億元和4億元。
依沃西單抗注射液項目進度

來源:米內(nèi)網(wǎng)項目進度數(shù)據(jù)庫
$173億大突破!和黃、樂普、中生......火力全開
據(jù)不完全統(tǒng)計,2023年至今已有28個項目達(dá)成出海交易,可統(tǒng)計累計首付款超11億美元,總交易額超173億美元,單筆交易達(dá)10億美元及以上的項目有8個,包括藥明生物的4款TCE雙抗/多抗、和黃醫(yī)藥的呋喹替尼、樂普生物的CMG901、中國生物制藥的Fcab結(jié)構(gòu)抗體等。
2023年至今創(chuàng)新藥出海情況
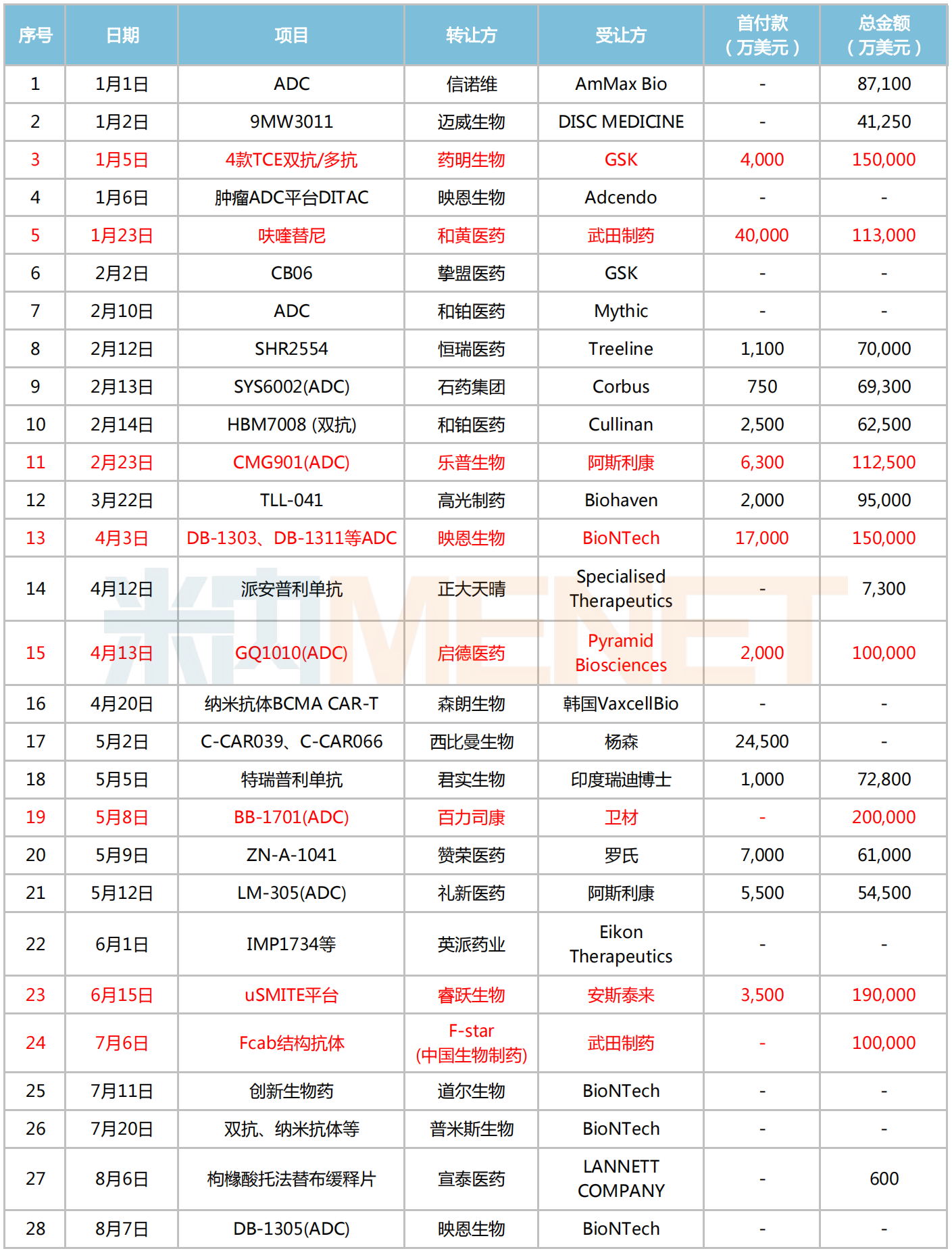
注:標(biāo)紅為交易總金額達(dá)10億美元及以上
來源:公司公告等,米內(nèi)網(wǎng)整理
呋喹替尼是和黃醫(yī)藥首個商業(yè)化的1類新藥,于2018年9月獲NMPA批準(zhǔn)上市,用于治療轉(zhuǎn)移性結(jié)直腸癌。米內(nèi)網(wǎng)數(shù)據(jù)顯示,該藥2022年在中國三大終端六大市場銷售規(guī)模首破7億元,同比增長39.86%。此前,和黃醫(yī)藥與武田制藥達(dá)成的海外授權(quán)合作,將進一步推進呋喹替尼在全球范圍的開發(fā)、生產(chǎn)及商業(yè)化。
近年來中國三大終端六大市場呋喹替尼銷售趨勢(單位:萬元)
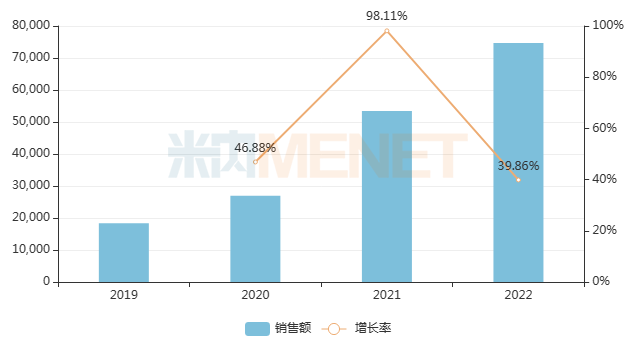
來源:米內(nèi)網(wǎng)格局?jǐn)?shù)據(jù)庫
CMG901是樂普生物開發(fā)的一款Claudin18.2靶向ADC,也是首個在中國及美國均獲批臨床的Claudin18.2抗體偶聯(lián)藥物。Claudin18.2于胃癌、胰腺癌及其他實體瘤中的表達(dá)呈高度選擇性及廣泛性,使其成為癌癥治療的理想靶點。此次CMG901的成功出海,標(biāo)志著樂普生物的創(chuàng)新研發(fā)技術(shù)已得到跨國藥企的認(rèn)可。
今年3月,中國生物制藥成功收購F-star,正式布局雙抗賽道。隨后在今年7月,F(xiàn)-star將Fcab結(jié)構(gòu)抗體授權(quán)給武田制藥共同開發(fā)。此項合作及許可協(xié)議的簽訂,進一步展現(xiàn)了F-star多抗平臺的巨大潛力,也是中國生物制藥國際化創(chuàng)新模式的又一突破性進展。
......
創(chuàng)新出海熱浪不斷,五大要點值得關(guān)注
“走自己的路,讓別人無路可走”,這便是近年來中國創(chuàng)新藥內(nèi)卷的縮影。
隨著資金的快速涌入和人才紅利的爆發(fā),同質(zhì)化競爭與日俱增,最典型的就是靶向PD-1生物藥,上市和在研產(chǎn)品過百項,產(chǎn)品售價也從幾十萬元/年迅速下降到約三萬元/年,市場空間直接縮水近10倍;疊加《以臨床價值為導(dǎo)向的抗腫瘤藥物臨床研發(fā)指導(dǎo)原則》、《新藥獲益-風(fēng)險評估技術(shù)指導(dǎo)原則》等重磅指導(dǎo)原則的出臺,進一步加大同質(zhì)化產(chǎn)品的臨床開發(fā)和上市難度,從而導(dǎo)致國產(chǎn)創(chuàng)新藥在國內(nèi)市場的收益較低,這就需要尋求海外市場,進一步擴大收益基本盤。
近年來靶向PD-1生物藥受理號批準(zhǔn)情況

來源:米內(nèi)網(wǎng)中國申報進度(MED)數(shù)據(jù)庫
目前國產(chǎn)創(chuàng)新藥企業(yè)出海模式主要有三種:一是自主出海,即中國藥企自主在海外開展臨床試驗和自建銷售團隊,比如百濟神州的BTK抑制劑澤布替尼,但是自主出海對資金和團隊要求非常高,成功者屈指可數(shù);二是借“船”出海,主要形式是License-out、專利授權(quán),即藥企將自身的產(chǎn)品或技術(shù)平臺的部分或全部權(quán)益售讓給海外藥企,借助海外藥企的經(jīng)驗或渠道實現(xiàn)新藥產(chǎn)品和技術(shù)平臺的出海;三是聯(lián)手出海,即中國藥企和海外藥企聯(lián)合開發(fā),分擔(dān)成本和收益。這是一種折中的形式,主要通過找到當(dāng)?shù)啬撤矫姹容^成熟的企業(yè),實現(xiàn)收購、兼并。
面對上述三種主流的出海方式,創(chuàng)新藥企該把握哪些要點,才能更從容地打贏出海攻堅戰(zhàn)?筆者認(rèn)為需重點關(guān)注以下五個方面:
一、合作方選擇的問題。國內(nèi)藥企不僅要向錢看,更要留意對方企業(yè)的動向。像今年7月,百濟神州一紙公告宣布終止與諾華就TIGIT抑制劑歐司珀利單抗的全球開發(fā)和商業(yè)化達(dá)成的合作協(xié)議。究其原因,業(yè)內(nèi)人士猜測,一方面是該產(chǎn)品或許更適合在國內(nèi)推進研發(fā);而另一方面是,此前BMS、默克等相關(guān)產(chǎn)品的失敗及退出讓這一賽道備受質(zhì)疑,如此環(huán)境下,諾華做出“退貨”選擇也并非不可理解。
二、同質(zhì)化的問題。在熱門的靶點上,我國企業(yè)能憑借效率和人才紅利加速進場,把創(chuàng)新藥打成白菜價,給患者和醫(yī)保減輕負(fù)擔(dān)。與此同時,這樣也會造成嚴(yán)重的資源浪費,企業(yè)的創(chuàng)新藥收入不盡如人意,白白投入了大量的時間及精力。
三、差異化創(chuàng)新的問題。作為后來者,我國企業(yè)想要在創(chuàng)新方面取得突破,發(fā)掘新靶點固然是一種思路,但也應(yīng)關(guān)注舊靶點的新發(fā)展,通過不同的技術(shù)路線,實現(xiàn)創(chuàng)新的彎道超車。
四、海外監(jiān)管的問題。目前來看,我國藥品評價體系仍處在不斷完善階段,由于一些歷史原因,海外監(jiān)管機構(gòu)對于我國的試驗數(shù)據(jù)接受度不高。因此,對于本土藥企而言,創(chuàng)新藥想要順利出海,應(yīng)與海外監(jiān)管機構(gòu)保持溝通,減少信息不對稱,并保證在研藥物試驗數(shù)據(jù)的真實性及完整性。
五、滿足臨床需求的問題。事實上,基本所有新藥的開發(fā)邏輯都一樣,不僅要療效好、夠安全、上市早,更重要是解決“未滿足的臨床需求”。因此,企業(yè)在產(chǎn)品立項時就需要充分考慮這一問題。
結(jié)語
經(jīng)過多年的耐心耕耘與沉淀,國內(nèi)創(chuàng)新藥出海逐步成為醫(yī)藥板塊交易的主旋律,也是未來發(fā)展的必經(jīng)之路。本土創(chuàng)新藥企與海外企業(yè)達(dá)成授權(quán)合作,既能在研發(fā)端實現(xiàn)優(yōu)勢互補、降低新藥研發(fā)風(fēng)險,又能在銷售端借助國際大藥企的銷售網(wǎng)絡(luò),使國產(chǎn)創(chuàng)新藥更快地打入國際市場。
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、公司公告等
注:米內(nèi)網(wǎng)《中國三大終端六大市場藥品競爭格局》,統(tǒng)計范圍是:城市公立醫(yī)院和縣級公立醫(yī)院、城市社區(qū)中心和鄉(xiāng)鎮(zhèn)衛(wèi)生院、城市實體藥店和網(wǎng)上藥店,不含民營醫(yī)院、私人診所、村衛(wèi)生室,不含縣鄉(xiāng)村藥店;上述銷售額以產(chǎn)品在終端的平均零售價計算。數(shù)據(jù)統(tǒng)計截至8月11日,如有疏漏,歡迎指正!

