近日,國家藥監(jiān)局重磅發(fā)布《中藥注冊管理專門規(guī)定》(以下簡稱“專門規(guī)定”)。
介乎于《藥品注冊管理辦法》和系列藥品研制技術(shù)指導(dǎo)原則之間的規(guī)范性文件,走向了注冊審評體系的聚光燈下,將于今年7月1日正式施行。
面對重磅落地的《專門規(guī)定》,中藥企業(yè)可謂幾家歡喜幾家愁。
01、五大核心要點(diǎn)
《專門規(guī)定》共11章82條,與新修訂《藥品管理法》、《藥品注冊管理辦法》有機(jī)銜接,結(jié)合了中醫(yī)藥的理論基礎(chǔ),充分吸納了藥品審評審批制度改革的成熟經(jīng)驗(yàn),有以下五大核心要點(diǎn):
1、審批體系“中國化”:要求推進(jìn)中醫(yī)藥理論、人用經(jīng)驗(yàn)和臨床試驗(yàn)“三結(jié)合”,建立具有中藥特點(diǎn)的審評審批體系;
2、評價(jià)體系“中藥化”:中藥的療效評價(jià)應(yīng)當(dāng)結(jié)合中醫(yī)藥臨床治療特點(diǎn),鼓勵(lì)運(yùn)用傳統(tǒng)中藥研究方法和現(xiàn)代科學(xué)技術(shù)研究開發(fā)中藥,形成結(jié)合中醫(yī)藥臨床治療特點(diǎn)的中藥療效評價(jià)指標(biāo);同時(shí),鼓勵(lì)將真實(shí)世界研究、新型生物標(biāo)志物、替代終點(diǎn)決策、以患者為中心的藥物研發(fā)、適應(yīng)性設(shè)計(jì)、富集設(shè)計(jì)等用于中藥療效評價(jià)。
3、開發(fā)路徑“創(chuàng)新化”:明確中藥注冊分類、研發(fā)路徑和模式,并對古代經(jīng)典名方中藥復(fù)方制劑的上市申請、臨床定位清晰且具有明顯臨床價(jià)值的中藥新藥等注冊申請?zhí)岢龊喕瘜徟?、?yōu)先審批、附條件審批、特別審批的相應(yīng)規(guī)定;
4、經(jīng)典名方“現(xiàn)代化”:支持研制基于古代經(jīng)典名方、名老中醫(yī)經(jīng)驗(yàn)方、醫(yī)療機(jī)構(gòu)中藥制劑等具有豐富中醫(yī)臨床實(shí)踐經(jīng)驗(yàn)的中藥新藥,鼓勵(lì)應(yīng)用新興科學(xué)和技術(shù)研究闡釋中藥的作用機(jī)理;來源于臨床實(shí)踐的中藥新藥,人用經(jīng)驗(yàn)?zāi)茉谂R床定位、適用人群篩選、療程探索、劑量探索等方面提供研究、支持證據(jù)的,可不開展II期臨床試驗(yàn)。
5、藥品注冊“規(guī)范化”:明確中藥注冊標(biāo)準(zhǔn)的研制目標(biāo),支持探索建立整體質(zhì)量控制方法和持續(xù)完善中藥質(zhì)量標(biāo)準(zhǔn)體系,明確中藥通用名稱的命名要求,對已上市中藥的說明書完善提出了要求。
02、大批中藥企業(yè)將停產(chǎn)?
《專門規(guī)定》的審批體系“中國化”、評價(jià)體系“中藥化”、開發(fā)路徑“創(chuàng)新化”、經(jīng)典名方“現(xiàn)代化”,對中藥創(chuàng)新藥是一個(gè)利好。
特別是要求推進(jìn)中醫(yī)藥理論、人用經(jīng)驗(yàn)和臨床試驗(yàn)“三結(jié)合”的具有中藥特點(diǎn)的審評審批體系,可謂是為中醫(yī)藥量身打造,過往中藥新藥綜合評價(jià)中藥的安全性、有效性和質(zhì)量可控性的很多問題,迎刃而解。
在新的體系下,中藥研發(fā)投入產(chǎn)出比有望迅速提升。
此外,《專門規(guī)定》對臨床定位清晰且具有明顯臨床價(jià)值的5種情形中藥新藥等的注冊申請實(shí)行優(yōu)先審評審批,并依法簡化古代經(jīng)典名方中藥復(fù)方制劑審批,中藥的獲批速度有望加快。
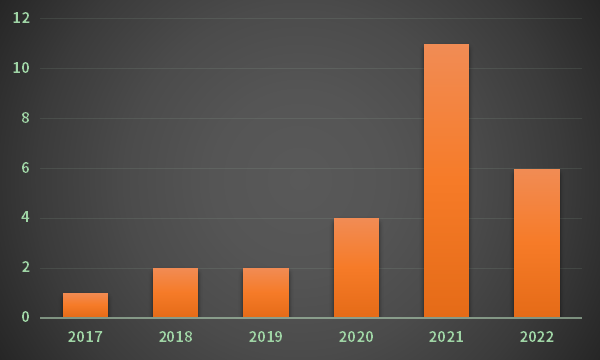
過去幾年,中藥創(chuàng)新藥獲批速度逐步迎來復(fù)蘇,《專門規(guī)定》的出臺(tái),有望進(jìn)一步引導(dǎo)中藥創(chuàng)新藥步入“快車道”。
中藥創(chuàng)新藥步入“對數(shù)增長期”,相關(guān)企業(yè)也有望從“估值修復(fù)”走向“拔估值”。
對中藥創(chuàng)新藥的“友好”,也引來了資本市場的歡愉。
2017-2022年中藥創(chuàng)新藥獲批上市數(shù)量
但是,就像硬幣有兩面,鼓勵(lì)良幣,則必驅(qū)逐劣幣。
《專門規(guī)定》還專門留了一個(gè)章節(jié),專門闡述“藥品名稱和說明書”要求,特別提到:中藥說明書【禁忌】、【不良反應(yīng)】、【注意事項(xiàng)】中任何一項(xiàng)在申請藥品再注冊時(shí)仍為“尚不明確”的,不予再注冊。
也就意味著,未來中藥將不再享有說明書方面的“特權(quán)”。
說明書再不修訂,就踢出市場。
由于歷史原因,我國約有七成以上中藥說明書中,【禁忌】、【不良反應(yīng)】、【注意事項(xiàng)】至少一欄為尚不明確。
數(shù)據(jù)顯示,我國中藥的批文總數(shù)為57526個(gè),即至少涉及4萬個(gè)中藥批文需要考慮再注冊的問題。
對中藥企業(yè)而言,中藥不良反應(yīng)“尚不明確”的藥品之后無法生存,那企業(yè)就需要做一系列的循證研究,把中藥說明書具體化。
循證研究涉及到安全性、有效性、經(jīng)濟(jì)性、創(chuàng)新性、適宜性、可及性等多個(gè)維度,這些科學(xué)規(guī)范的藥品臨床綜合評價(jià)是一筆不菲的開銷。
如果是年銷售過億元的產(chǎn)品,花幾百萬補(bǔ)充研究,既是一個(gè)學(xué)術(shù)推廣的過程,也是一種延長產(chǎn)品生命周期的方式,企業(yè)會(huì)樂于去做。
如果是年銷售幾十萬,或是剛過百萬級別,那么花幾百萬的代價(jià)做補(bǔ)充研究,企業(yè)就陷入兩難的境地。
雖然中成藥沒有一致性評價(jià)的洗牌,但這一次《專門規(guī)定》的出臺(tái),預(yù)計(jì)未來幾年,市場上大量說明書或者注冊信息不清晰的中藥批文可能被清退,變相來了一個(gè)洗牌。
公開資料顯示,近幾年來,國家藥監(jiān)局發(fā)布了100多種中藥說明書修訂的公告,其中“禁忌”項(xiàng)和“不良反應(yīng)”項(xiàng)等安全信息項(xiàng)內(nèi)容為修訂的重點(diǎn)。
信息不完整、不規(guī)范等問題一直是中成藥說明書需要面對的問題。
更深層次,中藥說明書的修訂將直接影響到再注冊、基藥、醫(yī)保準(zhǔn)入以及中藥品種保護(hù)等多個(gè)方面。
中藥說明書修改已迫在眉睫,對于具體的中藥企業(yè)而言:
基于前期研發(fā)底蘊(yùn)下中藥創(chuàng)新領(lǐng)軍企業(yè)已完善主要品種的說明書安全性信息,有望借助政策紅利占據(jù)更多市場份額;
部分企業(yè)已前瞻性開展主要非獨(dú)家大品種的循證醫(yī)學(xué)研究,可借助資金優(yōu)勢開展循證醫(yī)學(xué)臨床或真實(shí)世界研究完善說明書,非獨(dú)家品種市場份額將向龍頭企業(yè)集中,有望發(fā)揮科學(xué)的力量;
中藥企業(yè)在未來3年將持續(xù)開展循證醫(yī)學(xué)研究,有望帶動(dòng)中藥CRO行業(yè)的發(fā)展,特別是中藥臨床CRO相關(guān)的。
03、如何應(yīng)對新一輪行業(yè)洗牌?
全方位、系統(tǒng)的中藥注冊管理體系對中醫(yī)藥行業(yè)持續(xù)規(guī)范升級將產(chǎn)生積極推動(dòng)作用,有望促進(jìn)行業(yè)長期高質(zhì)量發(fā)展。
《專門規(guī)定》其實(shí)變相是倒逼企業(yè)向創(chuàng)新轉(zhuǎn)型,中藥企業(yè)對于管線的布局、發(fā)展方向也更加明確。
面對《專門規(guī)定》,中藥企業(yè)可以有以下的應(yīng)對措施:
1、將藥品的基本要求與中藥特殊性有機(jī)結(jié)合,開發(fā)過程中綜合考慮藥品安全性、有效性、質(zhì)量可控性;
2、辯證處理好中藥傳承與創(chuàng)新的關(guān)系,注重體現(xiàn)中醫(yī)藥原創(chuàng)思維及整體觀,又要適當(dāng)結(jié)合現(xiàn)代科學(xué)技術(shù);
3、可以重點(diǎn)挖掘“人用經(jīng)驗(yàn)”:中藥研制一般具有“源于臨床,用于臨床”的特點(diǎn),這次文件設(shè)立專章,對中藥人用經(jīng)驗(yàn)的具體內(nèi)涵,作為支持中藥安全性、有效性證據(jù)的合規(guī)性、藥學(xué)研究要求。同時(shí)還明確研制時(shí)可根據(jù)中藥人用經(jīng)驗(yàn)選擇不同的臨床研究路徑,人用經(jīng)驗(yàn)方有望是一個(gè)價(jià)值放大器;
4、合理利用中藥療效評價(jià)指標(biāo)的多元性,《專門規(guī)定》列舉了可作為中藥療效評價(jià)的8種情形,可以充分運(yùn)用。
5、合理利用新興科學(xué)和技術(shù)研究闡釋中藥的作用機(jī)理,比如AI技術(shù)。藥智NPAIEngine天然產(chǎn)物AI研發(fā)平臺(tái)正致力于解決這一大行業(yè)難題。
中醫(yī)藥的春風(fēng)來了,是春暖花開,還是“倒春寒”?考驗(yàn)著中藥企業(yè)的魄力與選擇。

