7月18日,上海陽光醫(yī)藥采購網(wǎng)發(fā)布《關(guān)于公布全國藥品集中采購(GY-YD2022-1)中選結(jié)果的通知》,第七批國采正式塵埃落定。涉及藥品類別多、優(yōu)化藥品帶量比例、采用“一省雙供”等,也成為此次集采的看點。
目前,國家集采已經(jīng)開展了七批八輪,在前五批化藥國采中,一直都是以過評+原研≥3家作為觸發(fā)機制,符合此條件的品種很大機會被納入國家集采,但這并不意味著一定能夠納入。
而從第七批國家集采開始,0+4或1+3成為新的進入國采依據(jù)。這意味著充分競爭的格局和定義再次起了變化。
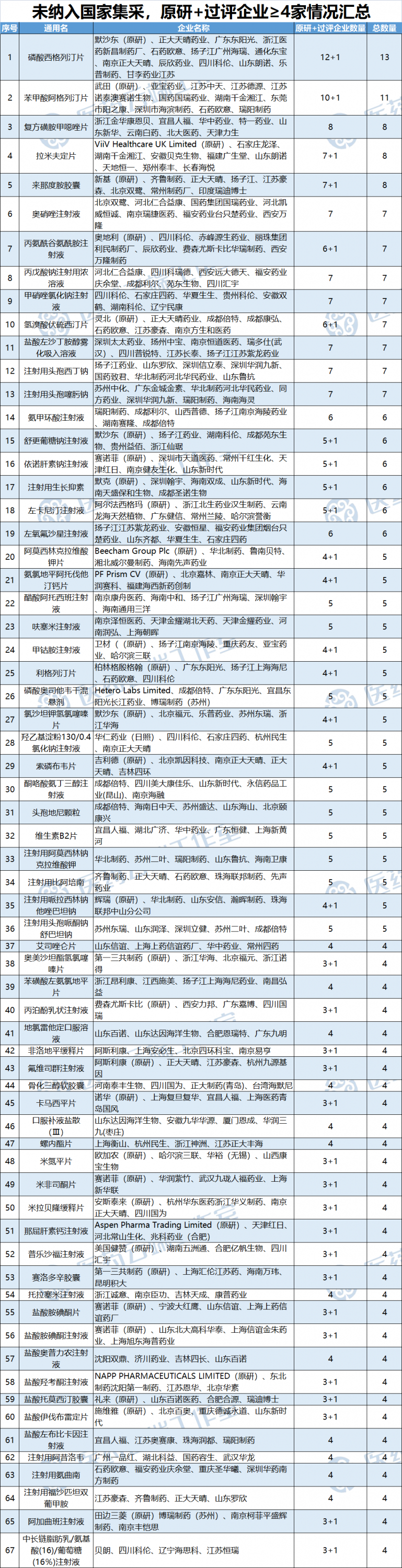
根據(jù)醫(yī)藥云端工作室統(tǒng)計,截至2022年7月18日, 在未納入國家集采的品種中已經(jīng)有67個品種原研+過評企業(yè)≥4家,初步具備納入國家集采的條件。
當然這67個品種不是所有品種都適合納入國家集采,對于一些特殊品種,如抗疫、國家儲備藥物等一般是不適合納入集采。通常都是納入到國家儲備,而不會輕易集采。
此外像氨氯地平阿托伐、伊伐布雷定,因為都是新藥上市,目前市場銷量還不算大,未得到市場檢驗,考慮到質(zhì)量因素不可控,也可能不會這么快被納入國家集采。
還有像被納入《臨床價值明確,無法推薦參比制劑的化學藥品目錄(第一批)》(公示)的口服補液鹽散,以及專利未到期的阿格列汀、西格列汀等產(chǎn)品也并不適合納入國家集采。
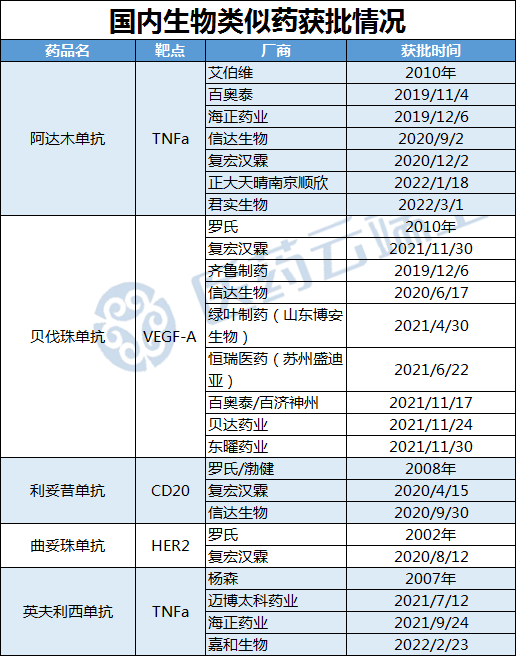
生物類似藥市場已具備一定規(guī)模,達到充分競爭條件
隨著一致性評價工作的進展,納入帶量采購的品種數(shù)量、范圍也逐步擴大,此前國家層面就開展過胰島素專項集采,為后續(xù)專項領(lǐng)域集采積累了一定的經(jīng)驗。同時,國家醫(yī)保局也多次釋放出信號,將生物類似藥納入到集中帶量采購。
2021年1月29日,在國新辦舉辦的新聞發(fā)布會上,國家醫(yī)保局副局長陳金甫指出,“生物類似藥跟化藥的仿制藥質(zhì)量評價方式上有區(qū)別,但是它有嚴格的質(zhì)量標準,下一步納入集采是毫無疑義的。”對于具體的集采方式,陳金甫表示質(zhì)量一定是作為優(yōu)先的考量,規(guī)則也一定要符合市場要求。
目前我國已經(jīng)成為生物類似藥在研數(shù)量最多的國家,先后有近200余個生物類似藥臨床試驗申請獲得批準,部分產(chǎn)品已經(jīng)完成三期臨床試驗并提交了上市注冊申請。
近年來,國內(nèi)生物類似藥的進展加快,阿達木單抗生物類似藥已有百奧泰、海正藥業(yè)、信達、復宏漢霖、正大天晴君實生物等 6 家獲批上市;貝伐珠單抗生物類似藥更是有齊魯制藥、信達生物、 綠葉制藥等8 家企業(yè)獲批;曲妥珠單抗首個生物類似藥也獲批上市。
生物類似藥在未來幾年內(nèi)將陸續(xù)登場,形成較為充分的競爭狀態(tài),滿足帶量采購的基本前提。從國內(nèi)生物類似藥的市場競爭格局看,已經(jīng)達到了充分競爭條件,并且從市場規(guī)模上看,也已具備一定的規(guī)模。因此第八批國采納入生物類似藥也并未不可能。