“三醫(yī)聯(lián)動”深入,審評審批改革、醫(yī)保支付調(diào)整、合理用藥監(jiān)管逐步完善,合力保障公眾用藥安全。針對醫(yī)藥領(lǐng)域重大違法違規(guī)行為,凝聚社會力量,鼓勵公眾舉報,無疑是推動社會共治的重要舉措。
國家醫(yī)療保障局日前發(fā)布《關(guān)于<違法違規(guī)使用醫(yī)療保障基金舉報獎勵辦法(征求意見稿)>公開征求意見的公告》,擬將舉報獎勵的范圍從欺詐騙保行為擴展到所有違法違規(guī)使用醫(yī)?;鸬男袨?,并大幅提高獎勵標準,獎勵上限由10萬升至20萬元。
無獨有偶,為加強藥品安全監(jiān)管,規(guī)范藥品注冊審評過程中有因檢查啟動工作,國家藥品監(jiān)督管理局藥品審評中心(CDE)亦于近期發(fā)文規(guī)范線索舉報有因檢查工作。
7月7日,CDE發(fā)布征求《藥品審評過程中有因檢查啟動工作程序(征求意見稿)》意見的通知,明確針對在審評過程中發(fā)現(xiàn)申報資料真實性存疑或者有明確線索舉報等,需要現(xiàn)場檢查核實的,應(yīng)當啟動有因檢查,必要時進行抽樣檢驗。
藥品監(jiān)管、醫(yī)保監(jiān)管兩份“征求意見稿”,無疑傳遞出非常強烈的監(jiān)管信號。業(yè)內(nèi)人士表示,無論是醫(yī)保資金使用,還是審評審批申報,監(jiān)管部門對于欺詐、造假等違法違規(guī)行為堅決“零容忍”,對于群眾舉報提供的違法違規(guī)線索,監(jiān)管部門將通過飛行檢查、有因檢查等措施重拳打擊,醫(yī)藥企業(yè)必須時刻利劍高懸,繃緊合法經(jīng)營之弦,守牢合規(guī)管理底線。
01、重獎鼓勵舉報欺詐騙保 藥企給回扣就列入失信名單
一直以來,國家醫(yī)保監(jiān)管將打擊欺詐騙保、維護醫(yī)?;鸢踩鳛槭滓蝿?wù),并針對欺詐騙保行為先后出臺多項整治措施。2018年11月,《欺詐騙取醫(yī)療保障基金行為舉報獎勵暫行辦法》正式印發(fā),初步建立起對舉報欺詐騙取醫(yī)療保障基金違法行為進行獎勵的制度。
本次政策修訂,旨在進一步發(fā)動社會力量參與違法違規(guī)行為監(jiān)督,共同維護醫(yī)?;鸢踩?。
根據(jù)《違法違規(guī)使用醫(yī)療保障基金舉報獎勵辦法(征求意見稿)》,舉報獎勵的適用范圍為:
自然人、法人或者其他組織(舉報人)向醫(yī)療保障行政部門反映涉嫌違法違規(guī)使用基本醫(yī)療保險(含生育保險)基金、醫(yī)療救助基金等醫(yī)療保障基金行為并提供相關(guān)線索。
而在獎勵標準方面,重點加大了資金獎勵力度:
醫(yī)療保障行政部門對符合獎勵條件的舉報人按照“案值”的一定比例給予一次性資金獎勵,最高不超過20萬元,最低不少于200元。
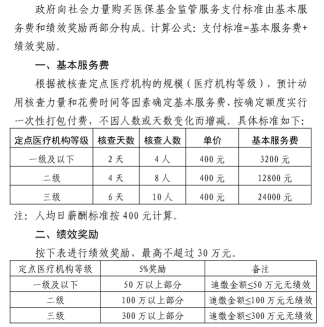
頂層政策定調(diào),全國各地也在加強社會力量監(jiān)督違法違規(guī)行為的支持力度。7月5日,陜西醫(yī)保局發(fā)布《向社會力量購買醫(yī)?;鸨O(jiān)管服務(wù)辦法(試行)》的通知,創(chuàng)新醫(yī)?;鸨O(jiān)管方式,動員社會力量參與監(jiān)管,第三方核查人員一天可得400元的勞務(wù)費,追繳金額超過一定額度的,還可以獲得5%的醫(yī)?;鹱防U金額,最高達30萬元。
醫(yī)?;鹗抢习傩盏?ldquo;看病錢”“救命錢”,任何違法違規(guī)使用醫(yī)?;鸬男袨?,損害的是全體參保人的權(quán)益。今年4月,同濟醫(yī)院騙保案震驚業(yè)內(nèi),據(jù)國家醫(yī)保局透露,該事件就是根據(jù)舉報線索查出的。
2022年3月,國家醫(yī)保局根據(jù)舉報線索,聯(lián)合國家衛(wèi)生健康委、市場監(jiān)管總局,對華中科技大學同濟醫(yī)學院附屬同濟醫(yī)院進行飛行檢查。經(jīng)查發(fā)現(xiàn),2017年1月—2020年9月期間,同濟醫(yī)院存在串換、虛記骨科高值醫(yī)用耗材問題,騙取醫(yī)?;鹬Ц?3343609.64元。此外,飛行檢查還發(fā)現(xiàn)同濟醫(yī)院2021年其他醫(yī)療行為涉嫌違規(guī)使用醫(yī)?;?107.41萬元。
事實上,中國醫(yī)藥行業(yè)的合規(guī)壓力已經(jīng)到了前所未有的程度。無論是對于下游的醫(yī)療機構(gòu),還是上游的制藥藥企,重視違法違規(guī)線索舉報,已經(jīng)成為嚴厲打擊商業(yè)賄賂的抓手。
早在2020年國家醫(yī)保局發(fā)布的《關(guān)于建立醫(yī)藥價格和招采信用評價制度的指導(dǎo)意見》中,已經(jīng)要求省級集中采購機構(gòu)日常運行中通過監(jiān)測、受理舉報等方式,掌握醫(yī)藥企業(yè)定價、投標、履約、營銷等方面的失信行為信息并予以記錄,對于回扣、壟斷控銷等行為將被列入“失信名單”。
此外,在“鼓勵醫(yī)藥企業(yè)修復(fù)信用”方面,“有效指證失信行為的實際控制主體”也在其列,行業(yè)此前對此頗為擔憂,因為政策意味著,舉報其他企業(yè)失信行為有助于修復(fù)信用,這可能進一步加劇醫(yī)藥行業(yè)的相互舉報的風氣。
行業(yè)觀點認為,過度診療、藥價虛高等醫(yī)療領(lǐng)域頑疾,是導(dǎo)致醫(yī)藥費用過快增長、醫(yī)?;鸫罅苛魇У闹苯釉颍で臓I商環(huán)境也大幅削弱了行業(yè)創(chuàng)新動力;針對藥品回扣、騙保等行為鼓勵舉報監(jiān)督,將有利于促進醫(yī)藥產(chǎn)品回歸核心價值。
02、明確線索舉報“有因飛檢” 真實性問題是重點
堅持“四個最嚴”監(jiān)管精神,因投訴舉報、監(jiān)督抽檢、不良反應(yīng)監(jiān)測和風險提示函等藥品質(zhì)量風險隱患為線索,開展有因檢查,同樣是藥品監(jiān)管的有力舉措。
在本次公開征求意見的《藥品審評過程中有因檢查啟動工作程序(征求意見稿)》(簡稱《意見》)中,明確提出:
第三條,藥品審評中心在審評過程中,發(fā)現(xiàn)申報資料真實性存疑或者有明確線索舉報等,需要現(xiàn)場檢查核實的,應(yīng)當啟動有因檢查,必要時進行抽樣檢驗;
第五條,藥品審評中心對藥品注冊審評工作中啟動有因檢查工作建立兩級審核管理機制;
第六條,必要時,有因檢查可與藥品注冊核查一并進行;
第三十一條,相關(guān)部門和人員應(yīng)當對舉報人的信息予以保密,保護舉報人的合法權(quán)益。
不難感受,國家監(jiān)管部門對臨床試驗數(shù)據(jù)質(zhì)量問題的重視。
事實上,臨床試驗各主體建立完善的質(zhì)量保證體系是確保項目高質(zhì)量完成的基石。切實提高臨床試驗質(zhì)量,促進臨床試驗水平的提升,強化臨床試驗研究者的責任意識,保證臨床試驗數(shù)據(jù)的真實性、準確性、完整性,確保研究過程可追溯性,正是藥品監(jiān)管部門多年來的工作重點。
針對審評過程涉及的有因檢查任務(wù)啟動細則,《意見》提出綜合分析研判“有明確線索舉報”的情況,明確線索舉報與有因檢查重點關(guān)注真實性問題,并嚴格落實舉報人保護政策。
臨床專家指出,在真實性問題方面,參與臨床試驗的各方都應(yīng)當敬畏生命、敬畏職責和規(guī)章,堅決不編造臨床試驗數(shù)據(jù);確保臨床試驗數(shù)據(jù)可溯源;保證正確使用試驗產(chǎn)品;不瞞報與試驗產(chǎn)品相關(guān)的嚴重不良事件、產(chǎn)品缺陷、違禁治療;確保注冊申報資料中數(shù)據(jù)質(zhì)量等。
實際上,自2015年以來,國家藥品監(jiān)管部門頒布多項法規(guī)政策,旨在強化藥品臨床試驗管理,切實提高藥品臨床試驗質(zhì)量,保證臨床試驗數(shù)據(jù)的真實性、準確性、完整性,確保研究過程可追溯性。
此外,最高人民法院、最高人民檢察院于2017年發(fā)布《關(guān)于辦理藥品、醫(yī)療器械注冊申請材料造假刑事案件適用法律若干問題的解釋》明確:
編造受試動物信息、受試者信息等藥物非臨床研究數(shù)據(jù)或者藥物臨床試驗數(shù)據(jù),影響藥品安全性、有效性評價結(jié)果的,以“故意提供虛假證明文件”論處,最高可判五年。
經(jīng)過數(shù)年臨床試驗重拳監(jiān)管,數(shù)據(jù)質(zhì)量已經(jīng)得到全產(chǎn)業(yè)鏈高度重視,監(jiān)管部門對數(shù)據(jù)質(zhì)量問題“零容忍”也得到了廣泛贊譽,一批違法違規(guī)案件也得到了行業(yè)關(guān)注。
2021年3月,國家藥品監(jiān)督管理局政務(wù)服務(wù)門戶更新《不予注冊批件發(fā)布通知》,杭州安旭生物科技股份有限公司的人類免疫缺陷病毒抗體/丙型肝炎病毒抗體/乙型肝炎病毒表面抗原/梅毒螺旋體抗體聯(lián)合檢測試劑盒,正式給予不予注冊批件;該產(chǎn)品存在多項臨床試驗真實性問題,并根據(jù)《中華人民共和國行政許可法》和《體外診斷試劑注冊管理辦法》給予處罰。
2021年12月,國家藥品監(jiān)督管理局發(fā)布對廣州海力特生物科技有限公司臨床試驗有因檢查情況,對于受理號為CSZ1800101的體外診斷試劑產(chǎn)品,有因檢查發(fā)現(xiàn)注冊申報資料中總結(jié)報告的數(shù)據(jù)與臨床試驗原始檢測數(shù)據(jù)不一致,臨床試驗數(shù)據(jù)無法溯源。
行業(yè)普遍認為,唯有真正夯實臨床數(shù)據(jù)質(zhì)量,才可能鑄就真正意義的高水平藥械科學研究和技術(shù)創(chuàng)新,切實保障上市藥品的安全、有效和質(zhì)量可控,從根本上提高中國制藥工業(yè)的國際競爭力。
藥品監(jiān)管、醫(yī)保監(jiān)管依據(jù)舉報線索,重拳打擊違法違規(guī)行為,都是優(yōu)化行業(yè)生態(tài),完善全鏈條監(jiān)管的舉措,從而讓老百姓能夠在藥品使用中真正得到安全保障。

