5月CDE共承辦藥品注冊申請691件
10個存量品種首次有企業(yè)申報一致性評價
4個1類新藥、6個2類改良型新藥報產
仿制申請有16個品種暫無國產獲批
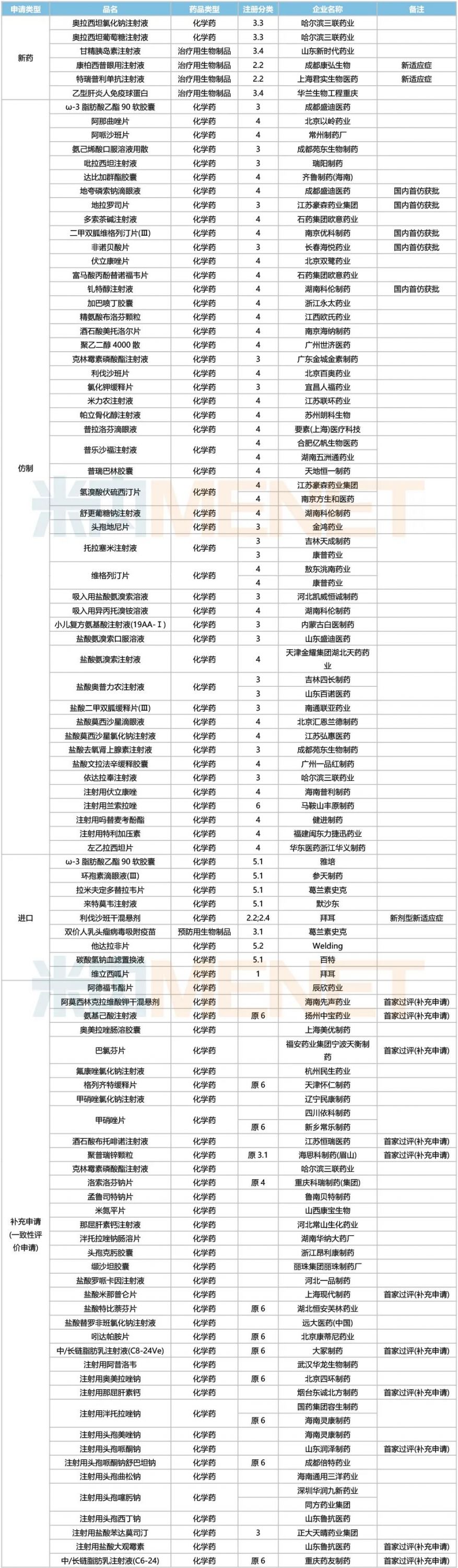
1個1類新藥獲批,3個品種有新適應癥獲批
5個首仿品種獲批,11個存量品種迎首家過評
CDE總體承辦情況
據(jù)米內網MED2.0中國藥品審評數(shù)據(jù)庫統(tǒng)計,2022年5月CDE共承辦藥品注冊申請691件。
2022年1月-5月CDE承辦藥品注冊申請情況(按受理號計)

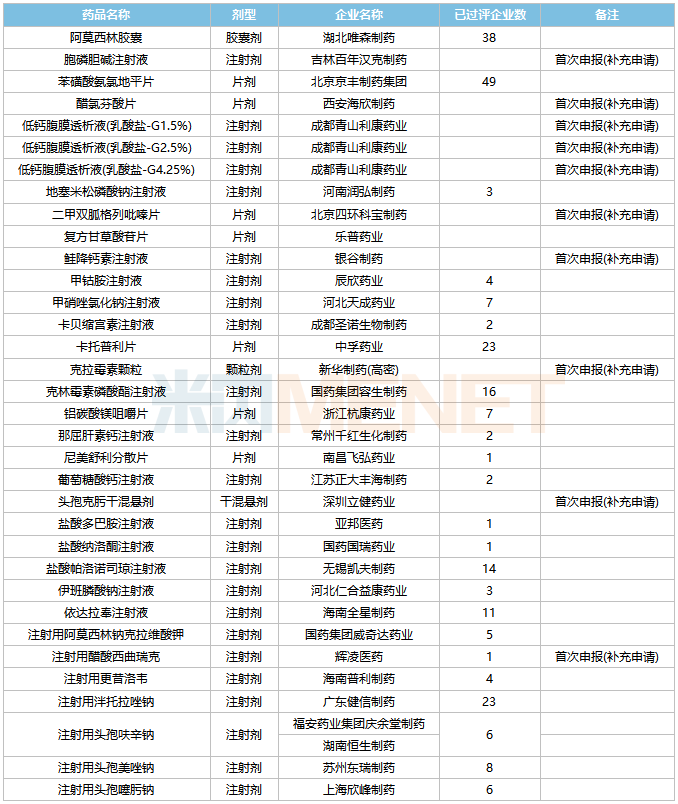
一致性評價補充申請承辦情況
2022年5月,34個品種的一致性評價補充申請獲CDE承辦。胞磷膽堿注射液、醋氯芬酸片、低鈣腹膜透析液(乳酸鹽-G1.5%)、低鈣腹膜透析液(乳酸鹽-G2.5%)、低鈣腹膜透析液(乳酸鹽-G4.25%)、二甲雙胍格列吡嗪片、鮭降鈣素注射液、克拉霉素顆粒、頭孢克肟干混懸劑、注射用醋酸西曲瑞克等10個品種為首次申報。
5月CDE補充申請(一致性評價)品種承辦情況
新藥申請承辦情況
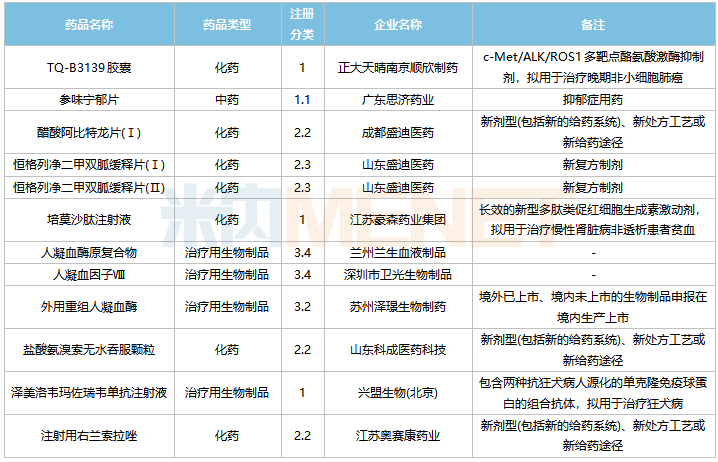
2022年5月,88個品種的新藥申請獲CDE承辦。其中1類新藥有61個,2類改良型新藥有21個,生物類似藥1個。
其中,正大天晴南京順欣制藥的TQ-B3139膠囊、廣東思濟藥業(yè)的參味寧郁片、江蘇豪森藥業(yè)集團的培莫沙肽注射液以及興盟生物(北京)的澤美洛韋瑪佐瑞韋單抗注射液均為1類新藥上市申請。
5月國內新藥上市申請承辦情況
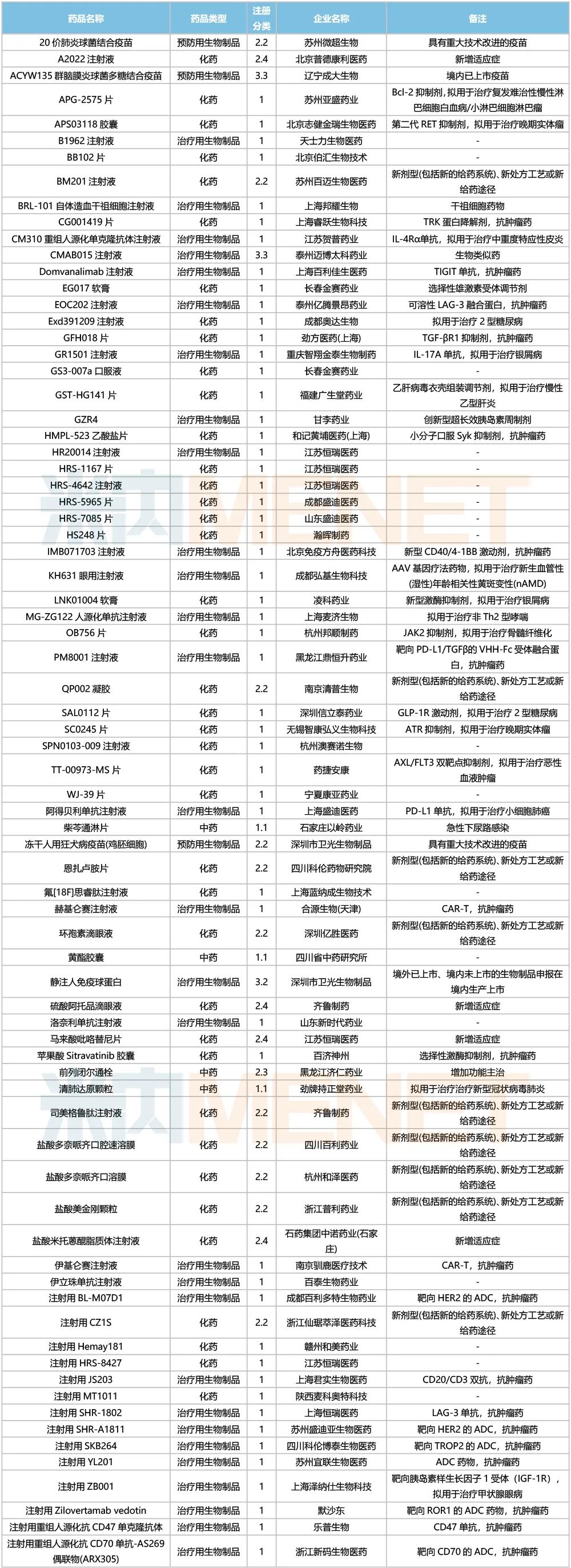
5月國內新藥臨床申請承辦情況
仿制申請承辦情況
2022年5月,77個品種的仿制申請獲CDE承辦,其中阿普米司特片、氨磺必利注射液、奧氮平鹽酸氟西汀膠囊、厄貝沙坦氨氯地平片、復方聚乙二醇電解質散(Ⅲ)、富馬酸伏諾拉生片、甲苯磺酸艾多沙班片、硫酸沙丁胺醇口服溶液、洛匹那韋利托那韋片、馬來酸阿塞那平舌下片、沙格列汀二甲雙胍緩釋片(Ⅰ)、沙格列汀二甲雙胍緩釋片(Ⅲ)、雙醋瑞因膠囊、通阻合牙日仙拜爾片、維氟醌乳膏、鹽酸哌甲酯緩釋片等16個品種暫無國產仿制藥獲批。
5月國內仿制申請承辦情況

進口申請承辦情況
2022年5月,36個品種的進口申請獲CDE承辦。其中1類新藥有21個,2類改良型新藥有7個,5.1類進口原研藥有2個,5.2類進口仿制藥有4個。楊森生物伊布替尼膠囊有新適應癥上市申請。
5月進口上市申請承辦情況
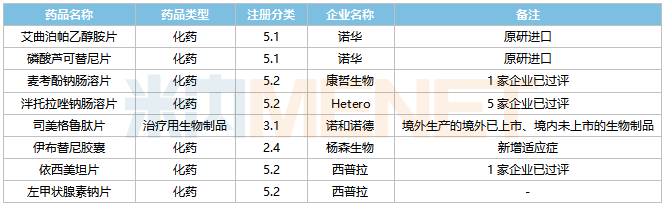
5月進口臨床申請承辦情況

獲批情況
2022年5月,拜耳1類新藥維立西呱片獲批國內上市,康柏西普眼用注射液、特瑞普利單抗注射液、利伐沙班干混懸劑等品種均有新適應癥獲批。
49個仿制藥獲批上市(含進口5.2類),地夸磷索鈉滴眼液(成都盛迪醫(yī)藥)、地拉羅司片(江蘇豪森藥業(yè)集團)、二甲雙胍維格列汀片(Ⅲ)(南京優(yōu)科制藥)、非諾貝酸片(長春海悅藥業(yè))、釓特醇注射液(湖南科倫制藥)為國內首仿。
38個存量品種有企業(yè)過評,阿莫西林克拉維酸鉀干混懸劑、氨基己酸注射液、巴氯芬片、酒石酸布托啡諾注射液、聚普瑞鋅顆粒、鹽酸米那普侖片、中/長鏈脂肪乳注射液(C8-24Ve)、注射用那屈肝素鈣、注射用頭孢哌酮鈉、注射用鹽酸大觀霉素、中/長鏈脂肪乳注射液(C6-24)等11個存量品種首次有企業(yè)過評。
5月上市申請品種及一致性評價品種獲批情況