自2017年12月國家首次公布通過一致性評價(jià)產(chǎn)品名單以來,至今已有不少產(chǎn)品“3年內(nèi)完成一致性評價(jià)”的期限已過。目前,相關(guān)品種未申報(bào)一致性評價(jià)的批文正面臨不予再注冊的時(shí)間關(guān)卡。
通過一致性評價(jià)促進(jìn)仿制藥產(chǎn)業(yè)升級已然進(jìn)入了驗(yàn)收階段,批文數(shù)量就是一個(gè)重要指標(biāo)。根據(jù)咸達(dá)藥海數(shù)據(jù)庫數(shù)據(jù),我國國產(chǎn)化學(xué)藥品批文總數(shù)最高峰時(shí)有128626條。而截至2022年4月,我國國產(chǎn)化學(xué)藥只剩下92189條批文。
這意味著,國內(nèi)化學(xué)藥批文的洗牌速度遠(yuǎn)遠(yuǎn)高于新增獲批速度,一致性評價(jià)對仿制藥產(chǎn)業(yè)升級的作用效果顯著。
01、批文數(shù)TOP50品種看點(diǎn)
以歷史批文數(shù)排名,國產(chǎn)化學(xué)藥歷史批文數(shù)最多的前50個(gè)品種,在峰值期間共有33362個(gè)批文,而截至2022年4月剩下21792個(gè)批文。
2016年以來,推動(dòng)化學(xué)藥批文淘汰的最大動(dòng)力,業(yè)界認(rèn)為是一致性評價(jià)政策。根據(jù)政策要求,化學(xué)藥品新注冊分類實(shí)施前批準(zhǔn)上市的含基本藥物品種在內(nèi)的仿制藥,自首家品種通過一致性評價(jià)后,其他藥品生產(chǎn)企業(yè)的相同品種原則上應(yīng)在3年內(nèi)完成一致性評價(jià)。逾期未完成的,企業(yè)經(jīng)評估認(rèn)為屬于臨床必需、市場短缺品種的,可向所在地省級藥品監(jiān)管部門提出延期評價(jià)申請,經(jīng)省級藥品監(jiān)管部門會(huì)同衛(wèi)生行政部門組織研究認(rèn)定后,可予適當(dāng)延期。逾期再未完成的,不予再注冊。
無參比制劑“祖父藥”
如表1所示,從化學(xué)藥歷史批文數(shù)最多的前50品種的批文淘汰情況看,排名前列的不少是沒有參比制劑、啟動(dòng)不了一致性評價(jià)的品種。此外,還存在一種情況:有不少品種,雖然有企業(yè)申報(bào)一致性評價(jià),但沒有獲批一致性評價(jià)。
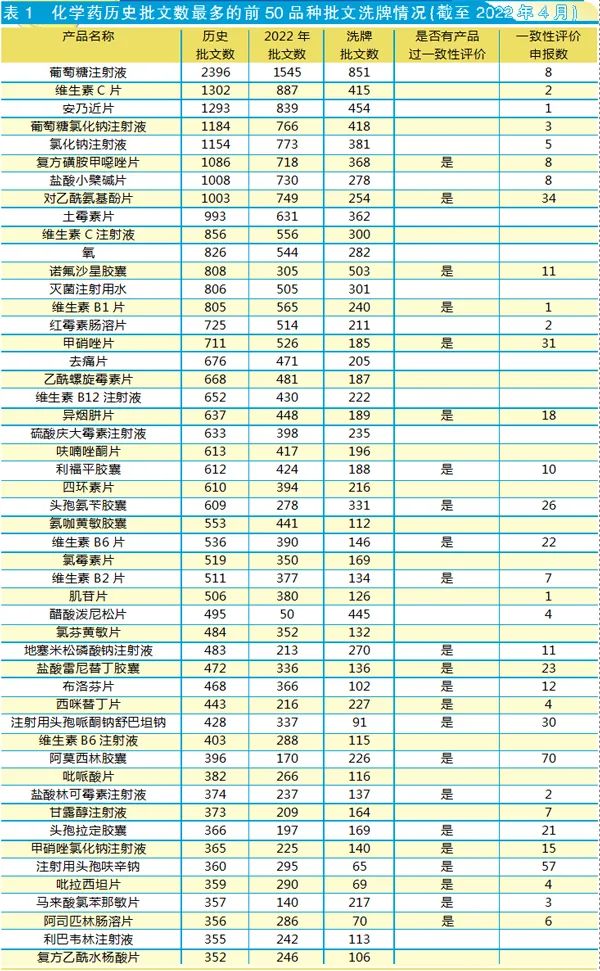
對于沒有參比制劑的這些“祖父藥”,究竟要不要啟動(dòng)一致性評價(jià)呢?讓業(yè)界有此顧慮的原因,一方面,這些批文大部分是2007年以前獲批的;另一方面,這些產(chǎn)品在國外都是豁免一致性評價(jià)的產(chǎn)品。
企業(yè)放棄再注冊析因
化學(xué)藥品歷史批文數(shù)排名前列的品種中,除了不少?zèng)]通過一致性評價(jià)的,還有不少批文沒有再注冊,預(yù)計(jì)不少批文是在2010年GMP改造升級時(shí)企業(yè)放棄再注冊。2009年啟動(dòng)的各省招標(biāo),特別是醫(yī)院市場的最低價(jià)中標(biāo)等政策,使得不少產(chǎn)品沒有中標(biāo)。而如果多年沒有生產(chǎn)銷售,再注冊的維護(hù)需要一定費(fèi)用,企業(yè)就有可能主動(dòng)放棄批文。
預(yù)判消逝批文下一站
一旦有首家獲批一致性,那么預(yù)計(jì)下一步又會(huì)有不少批文被淘汰。筆者統(tǒng)計(jì),國產(chǎn)化學(xué)藥歷史批文數(shù)最多的前50個(gè)品種中,剩下的21792個(gè)批文預(yù)計(jì)會(huì)被淘汰7662個(gè)(以已過評品種的批文數(shù)計(jì)算)。其中,淘汰批文最多的品種是對乙酰氨基酚片,至少715個(gè)批文五年內(nèi)報(bào)廢;其次是復(fù)方磺胺甲噁唑片,預(yù)計(jì)至少710個(gè)批文在五年內(nèi)消失。
阿莫西林膠囊申報(bào)最熱
一致性評價(jià)申報(bào)數(shù)可以側(cè)面反映出廠家對這些老批文市場價(jià)值的認(rèn)可度;但也有可能是因?yàn)樵纤幈粔艛啵瑢?dǎo)致企業(yè)啟動(dòng)不了一致性評價(jià)。排名前50品種中,最多企業(yè)申報(bào)一致性評價(jià)的是阿莫西林膠囊,共有70個(gè)一致性評價(jià)受理。
02、處方集品種過評情況
TOP20淘汰2000個(gè)批文
慢性病藥和注射劑是一致性評價(jià)的熱門品種。咸達(dá)藥海遨游數(shù)據(jù)庫將通過一致性評價(jià)和處方目錄集的批文數(shù)的品種進(jìn)行排序,分析發(fā)現(xiàn),批文數(shù)前20的熱門品種預(yù)計(jì)也要淘汰近2000個(gè)批文(未通過一致性評價(jià)的批文)。但是,注射劑大部分是2020年以后獲批的,研發(fā)成本較低,最終也許能夠保留更多批文。
而剩下的批文,未來仍需面臨集采的持續(xù)降價(jià)壓力。通過一致性評價(jià)的批文如果一直沒中標(biāo),會(huì)否不選擇再注冊?值得進(jìn)一步探討。
如表2所示,實(shí)際上,不少通過一致性評價(jià)(含視同)和處方集的品種屬于近幾年新獲批的仿制藥,如他達(dá)拉非片、恩替卡韋片、替格瑞洛片等。
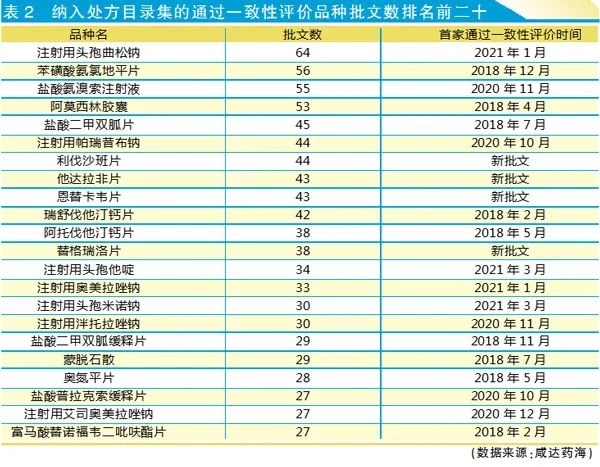
從時(shí)間來看,已經(jīng)不能再申報(bào)一致性評價(jià)的品種有苯磺酸氨氯地平片、阿莫西林膠囊、鹽酸二甲雙胍片、瑞舒伐他汀鈣片、阿托伐他汀鈣片、鹽酸二甲雙胍緩釋片、蒙脫石散、奧氮平片和富馬酸替諾福韋二吡呋酯片。
三年期限后是否保批文
理論上講,首家通過一致性評價(jià)后三年就不接受一致性評價(jià)的申報(bào)。阿莫西林膠囊2018年4月獲批一致性評價(jià),理論上2021年4月就停止申報(bào)一致性評價(jià)。然而,重慶麥克福、吉林省利華、珠海聯(lián)邦、國藥集團(tuán)威奇達(dá)、重慶科瑞和好醫(yī)生藥業(yè)都在2021年4月以后申報(bào)了一致性評價(jià)。
按照政策,“自首家品種通過一致性評價(jià)后,其他藥品生產(chǎn)企業(yè)的相同品種原則上應(yīng)在3年內(nèi)完成一致性評價(jià)”,即3年期限過后不能再申報(bào)一致性評價(jià)。理論上講還是可以重新以仿制藥申報(bào),但是,舊批文沒有被注銷前,這些企業(yè)也不能申報(bào)仿制藥。
此外,阿莫西林膠囊批文仍有再注冊的企業(yè)。比如吉林敖東延邊藥業(yè),雖沒有啟動(dòng)一致性評價(jià),但2021年7月再注冊成功;同樣情況的還有內(nèi)蒙古通遼制藥等。再注冊的啟動(dòng)時(shí)間往往是提前半年,未獲批一致性評價(jià)的產(chǎn)品如果趕在再注冊受理截止時(shí)間前申報(bào)再注冊,那么獲批再注冊的時(shí)間有可能就是在截止時(shí)間后的半年。
假設(shè)一個(gè)產(chǎn)品的再注冊在2022年4月到期,一致性評價(jià)截止日為2022年3月,該產(chǎn)品2022年2月提交一致性評價(jià)申請,那么,即便一致性評價(jià)尚未獲批,企業(yè)的再注冊是否就能夠獲批呢?這是業(yè)界比較關(guān)注的一個(gè)細(xì)節(jié)。
思考題<<<
哪些批文值得再注冊?
國內(nèi)企業(yè)投資仿制藥一致性評價(jià),歸根到底看中的是批文洗牌帶來的市場機(jī)會(huì)。
然而,從阿莫西林膠囊這個(gè)品種來看,各省對于“自首家品種通過一致性評價(jià)后,其他藥品生產(chǎn)企業(yè)的相同品種原則上應(yīng)在3年內(nèi)完成一致性評價(jià)。逾期再未完成的,不予再注冊”政策的落地并沒有形成統(tǒng)一的執(zhí)行細(xì)則。
在鼓勵(lì)企業(yè)做一致性評價(jià)的政策中,同品種藥品3家及以上企業(yè)通過一致性評價(jià)的,不予在醫(yī)療機(jī)構(gòu)銷售未通過一致性評價(jià)的產(chǎn)品,目前這一政策基本已經(jīng)執(zhí)行落地了。
另一方面,從官方數(shù)據(jù)看,首家通過一致性評價(jià)企業(yè)及首家過一致性評價(jià)的時(shí)間,目前沒有全面的公開數(shù)據(jù)。這意味著,哪些產(chǎn)品3年后不能啟動(dòng)一致性評價(jià)沒有權(quán)威數(shù)據(jù)。此外,對于沒有啟動(dòng)一致性評價(jià)的產(chǎn)品,再注冊能否延遲,以及延遲的標(biāo)準(zhǔn),各地尚無統(tǒng)一規(guī)則。
通過批文洗牌提高行業(yè)集中度,是制定政策的初衷。而批文洗牌的延遲,會(huì)影響企業(yè)申報(bào)一致性評價(jià)的意愿。目前大都靠企業(yè)自覺,即企業(yè)主動(dòng)不申報(bào)再注冊。對于是否保批文,業(yè)界保持一定的觀望態(tài)度。
但是,在產(chǎn)業(yè)升級的大背景下,對于那些申報(bào)扎堆的品種,再投入保批文風(fēng)險(xiǎn)巨大。而對于過評和申報(bào)廠家較少的品種,則再投入保批文的風(fēng)險(xiǎn)與機(jī)會(huì)并存。



