3月22日,國家藥品監(jiān)督管理局批準創(chuàng)新型PD-1抑制劑漢斯狀®(斯魯利單抗、H藥)用于治療經(jīng)標準治療失敗的、不可切除或轉(zhuǎn)移性微衛(wèi)星高度不穩(wěn)定(MSI-H)實體瘤患者。
斯魯利單抗是復宏漢霖首款自主研發(fā)的創(chuàng)新型抗PD-1單抗,截至目前,該藥已獲得中國、美國、歐盟等國家及地區(qū)的多項臨床試驗許可,在全球范圍同步開展了多項腫瘤免疫臨床試驗,廣泛覆蓋肺癌、食管癌、頭頸癌和胃癌等適應癥。本次MSI-H實體瘤適應癥在中國獲批,標志著PD-1領(lǐng)域迎來了全新的治療選擇,并在“泛癌種”免疫治療方面有機會進一步填補未被滿足的臨床需求。
差異化競爭
“泛癌種”精準治療
MSI(microsatellite instability)是指“微衛(wèi)星不穩(wěn)定”。“微衛(wèi)星”是一段分布在人類基因組中的簡單重復的DNA序列,當“微衛(wèi)星”在DNA復制時發(fā)生錯誤,出現(xiàn)堿基插入或錯配,長期的錯誤堿基積累就會引發(fā)重大疾病風險。MSI可以分為高度(High)不穩(wěn)定(MSI-H)、低度不穩(wěn)定(Low)(MSI-L)和穩(wěn)定(Stable)(MS-S),而微衛(wèi)星高度不穩(wěn)定(MSI-H)常見于子宮內(nèi)膜癌、結(jié)直腸癌、胃癌、腎細胞癌、卵巢癌等。
研究數(shù)據(jù)顯示,MSI-H在所有癌種中的發(fā)生率約為14%,根據(jù)我國各腫瘤發(fā)病率及MSI-H各腫瘤發(fā)生率測算,國內(nèi)每年新發(fā)MSI-H的實體瘤患者約為30多萬人,存在著巨大的未被滿足的臨床需求。
如今,隨著精準醫(yī)學的不斷發(fā)展,MSI越來越成為實體瘤患者免疫治療效果的重要生物標志物,開啟了泛瘤種精準免疫治療時代。由于該類患者通常對免疫檢查點抑制劑有較高的應答率,以PD-1/PD-L1單抗為代表的免疫治療,患者的臨床獲益顯著。美國國立綜合癌癥網(wǎng)絡(luò)(NCCN)、中國臨床腫瘤學會(CSCO)等國內(nèi)外權(quán)威指南,一致推薦PD-1單抗用于MSI-H晚期實體瘤或結(jié)直腸癌患者的治療。
這一分類方法的優(yōu)勢在于,以腫瘤標志物特征為依據(jù),檢測到患者MSI-H且滿足治療需求即可使用斯魯利單抗進行治療,而不需要按照傳統(tǒng)的腫瘤原發(fā)灶部位與病理分型對患者進行篩選,適用癌種范圍廣,極大提升了治療覆蓋面。
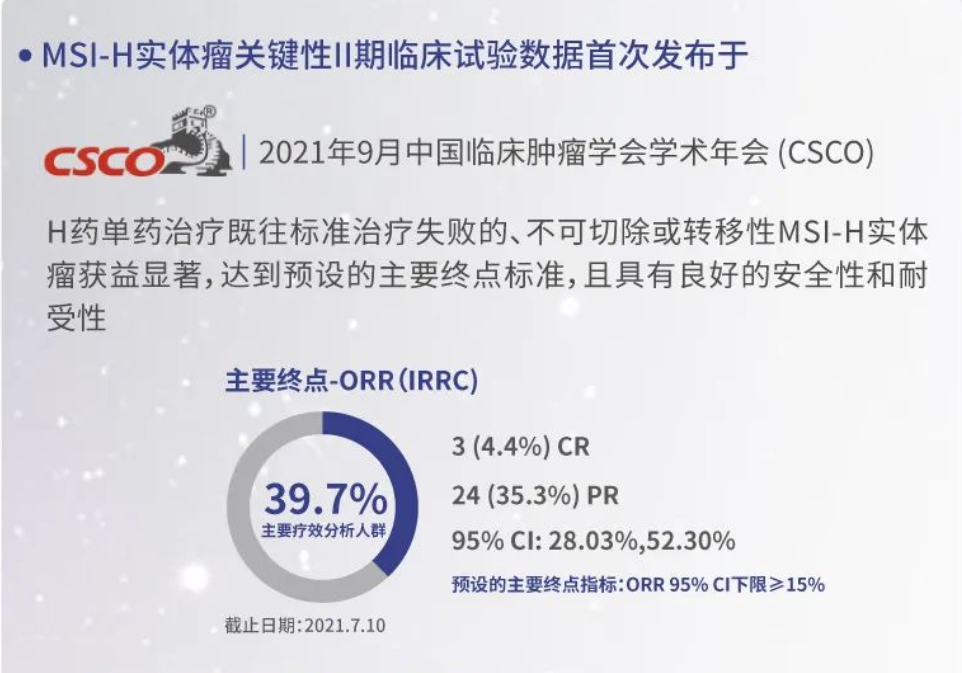
斯魯利單抗的獲批主要是基于一項單臂、多中心、關(guān)鍵性Ⅱ期臨床試驗,由南京金陵醫(yī)院腫瘤中心秦叔逵教授和上海同濟大學附屬東方醫(yī)院李進教授擔任主要研究者。截至2021年7月10日,該試驗共入組108名患者,其中68名經(jīng)中心實驗室或研究中心確認MSI-H的患者被納入主要療效分析人群。主要療效分析人群中,經(jīng)IRRC評估的ORR為39.7%(95%CI:28.03,52.30;3例完全緩解,24例部分緩解)。研究結(jié)果表明,H藥單藥治療既往標準治療失敗的、不可切除或轉(zhuǎn)移性MSI-H實體瘤獲益顯著,達到預設(shè)的主要終點標準,且具有良好的安全性和耐受性。該項臨床試驗結(jié)果以口頭匯報形式于第24屆全國臨床腫瘤學大會暨2021年CSCO學術(shù)年會上首次發(fā)布。
H藥漢斯狀®關(guān)鍵性Ⅱ期臨床研究主要聯(lián)合研究者秦叔逵教授表示:
以PD-1抑制劑為代表的免疫檢查點抑制劑已在眾多疾病領(lǐng)域展開了積極探索,并在多個腫瘤治療領(lǐng)域取得了突破性的進展。漢斯狀®針對MSI-H實體瘤的臨床研究數(shù)據(jù)優(yōu)異,相信能夠積極改善臨床療效,為中國腫瘤精準治療提供新思路和新選擇。
H藥漢斯狀®關(guān)鍵性Ⅱ期臨床研究主要聯(lián)合研究者李進教授指出:
漢斯狀®的獲批上市給MSI-H實體瘤患者帶去了新希望,更好地滿足腫瘤臨床治療用藥需求。該產(chǎn)品在推動國內(nèi)腫瘤治療發(fā)展的同時,對于提升‘泛癌種’治療認知及推動腫瘤精準免疫治療發(fā)展起到了積極的作用。
復宏漢霖斯魯利單抗獲批上市,成為國內(nèi)上市的第9款PD-1單抗產(chǎn)品。有別于以往大部分PD-1單抗以單一癌種、小癌種適應癥申報上市,作為一個“無視癌種”的廣譜抗癌藥,復宏漢霖有機會憑借差異化的競爭優(yōu)勢脫穎而出。
“Combo+Global”戰(zhàn)略
積極探索聯(lián)合治療方案
目前,國內(nèi) PD-1競爭已經(jīng)進入白熱化,對于細分賽道上的每一家企業(yè)而言,如何通過精準選擇適應癥領(lǐng)域開拓新機遇,已經(jīng)成為決定市場成敗的關(guān)鍵要素。
事實上,在大多數(shù)未進行標志物檢測的實體瘤患者中,PD-1/L1單藥治療的整體有效率有限,僅從適應癥角度考量,受制于治療效果等因素,現(xiàn)有PD-1藥物單藥應用場景充滿局限,聯(lián)合用藥已經(jīng)成為腫瘤免疫治療領(lǐng)域重要的發(fā)展方向。
在成熟的創(chuàng)新研發(fā)平臺支持下,復宏漢霖前瞻性地布局了一個多元化、高質(zhì)量的產(chǎn)品管線,涵蓋20多種創(chuàng)新單克隆抗體,并以斯魯利單抗為核心,快速推進各種免疫聯(lián)合療法的開發(fā)并拓寬治療領(lǐng)域,旨在通過“1+1>2”的方式為患者提供更優(yōu)的治療解決方案。
圍繞“Combo+Global”的戰(zhàn)略部署,復宏漢霖積極就化療、自有VEGF、EGFR靶點單抗等治療方案進行免疫聯(lián)合療法,不僅全面覆蓋了肺癌、食管癌、胃癌、頭頸癌等高發(fā)大瘤種,還針對中國的癌癥發(fā)病人群特點實施差異化臨床開發(fā)。
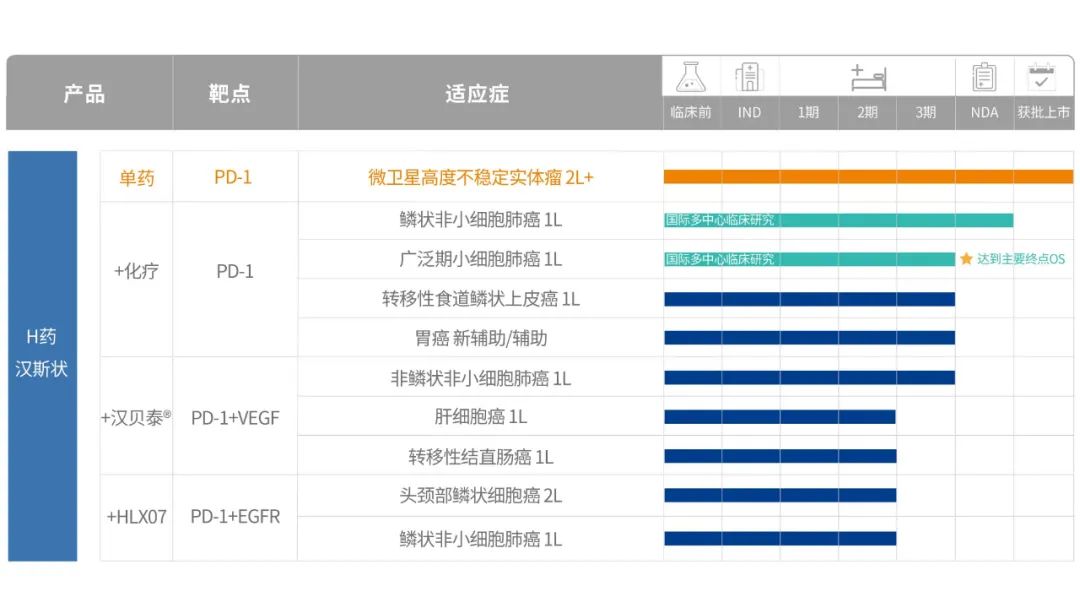
以斯魯利單抗和漢貝泰®(HLX04)聯(lián)合療法為例,從療效上看,靶向VEGF的貝伐珠單抗本身具有抗血管生成作用,不僅對腫瘤血管生成和癌細胞的增殖有直接影響,還能增強腫瘤的免疫原性、T細胞的浸潤等,增強殺滅癌細胞的能力;此外,斯魯利單抗和漢貝泰®兩款產(chǎn)品均為復宏漢霖腫瘤產(chǎn)品管線中極具代表性的產(chǎn)品,公司能夠通過對研發(fā)、生產(chǎn)成本的嚴格把控,將腫瘤免疫聯(lián)合療法費用控制到更低,大幅改善患者的醫(yī)療負擔,促進聯(lián)合治療的普及化。
繼MSI-H實體瘤之后,復宏漢霖后續(xù)將全力覆蓋更多適應癥,并積極探索聯(lián)合療法。圍繞斯魯利單抗這一免疫治療的關(guān)鍵產(chǎn)品,公司在國內(nèi)率先開展了聯(lián)合治療研究,目前圍繞斯魯利單抗已開展了9項聯(lián)合療法臨床試驗,均處于Ⅱ/Ⅲ期臨床階段。
對標全球重磅
走國際化發(fā)展之路
中國醫(yī)藥產(chǎn)業(yè)正在邁向高質(zhì)量發(fā)展的嶄新階段,《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》提出:支持企業(yè)開展創(chuàng)新藥國內(nèi)外同步注冊,支持創(chuàng)新藥企開展全球多中心臨床研究。在頂層政策支持下,復宏漢霖率先搭建創(chuàng)新研發(fā)成果高效轉(zhuǎn)化平臺,持續(xù)構(gòu)建國際化的生產(chǎn)體系及質(zhì)量管理體系,走出了屬于自己的國際化發(fā)展之路。
作為腫瘤免疫治療的“基石”,復宏漢霖針對斯魯利單抗進行積極的國際化布局,眾多國際多中心臨床試驗開展是一大亮點。據(jù)統(tǒng)計,復宏漢霖在中國、土耳其、波蘭等國家及地區(qū)的臨床研究累計入組了超過2800名患者,是國內(nèi)擁有國際臨床數(shù)據(jù)較多的PD-1產(chǎn)品之一。
在適應癥開發(fā)方面
斯魯利單抗在全球PD-1市場的競爭中,亮眼的臨床數(shù)據(jù)展現(xiàn)出高度的潛力。去年年底,復宏漢霖宣布斯魯利單抗聯(lián)合化療一線治療廣泛期小細胞肺癌(ES-SCLC)的隨機、雙盲、國際多中心Ⅲ期臨床ASTRUM-005研究的第一次期中分析達到了總生存期(OS)的主要研究終點。
該研究臨床結(jié)果顯示:斯魯利單抗聯(lián)合卡鉑-依托泊苷在總體人群和中國亞組均可延長中位總生存期(OS),斯魯利單抗組和安慰劑組的總?cè)巳褐形籓S分別為15.38個月和11.10個月,總?cè)巳航档退劳鲲L險達38%(中國亞組達41%),p<0.001,兩個給藥組的2年總生存率(OSR)分別為43.2%和8.0%,且具有良好的安全性。眾所周知,2020年12月、2021年3月,因為臨床試驗失利,O藥、K藥先后主動撤回了SCLC適應癥的申請。這意味著,斯魯利單抗有望成為全球首個一線治療SCLC的PD-1單抗產(chǎn)品。
去年9月,復宏漢霖宣布斯魯利單抗聯(lián)合化療一線治療局部晚期或轉(zhuǎn)移性鱗狀非小細胞肺癌(sqNSCLC)的上市注冊申請獲得國家藥監(jiān)局受理。據(jù)悉,本次上市申請涉及的III期臨床研究是由中國研究者牽頭開展的樣本量最大的sqNSCLC國際性臨床研究,全球范圍共入組500余名受試者。
兩項肺癌國際多中心臨床研究于全球多地包括中國、歐盟波蘭、土耳其等開設(shè)研究中心,其中納入高加索人種的比例超過30%,充分的國際臨床試驗數(shù)據(jù)有望支持美國、歐盟等主流法規(guī)市場的申報,也為全球性臨床應用奠定基礎(chǔ)。
研發(fā)管線全面開花,全球臨床試驗持續(xù)推進,保障商業(yè)化產(chǎn)品和臨床階段產(chǎn)品的生產(chǎn)對企業(yè)而言是全方位的考驗。2020年以來,為滿足持續(xù)增長的臨床需求,復宏漢霖積極推動了生產(chǎn)規(guī)模的提升,完成500L向2000L的生產(chǎn)設(shè)備擴容,公司徐匯基地現(xiàn)擁有商業(yè)化產(chǎn)能24000L;松江基地的產(chǎn)能建設(shè)也在穩(wěn)步推進。
在質(zhì)量管理體系方面
近年來徐匯基地及配套的質(zhì)量管理體系已通過由中國國家藥品監(jiān)督管理局(NMPA)、歐洲藥品管理局(EMA)、歐盟質(zhì)量受權(quán)人(QP)以及國際商業(yè)合作伙伴進行的多項實地核查及審計,并獲得了中國與歐盟GMP認證,由此成為了國內(nèi)首個獲得歐盟GMP認證用于生產(chǎn)自主研發(fā)抗體生物藥的GMP工廠。
此外,2019年攜手商業(yè)合作伙伴KG Bio,復宏漢霖授權(quán)斯魯利單抗首個單藥療法及兩項聯(lián)合療法在東南亞地區(qū)10個國家的獨家開發(fā)和商業(yè)化權(quán)利,H藥“出海”進程持續(xù)提速。
作為復宏漢霖單抗創(chuàng)新藥產(chǎn)品管線中的先導產(chǎn)品,斯魯利單抗的商業(yè)化號角已經(jīng)吹響。這不僅證明了復宏漢霖持續(xù)性的產(chǎn)業(yè)化創(chuàng)新能力,更凸顯了符合國際水平的生產(chǎn)、商業(yè)化實力,展現(xiàn)了企業(yè)加速從Biotech邁向Biopharma重大轉(zhuǎn)型的決心。



