2月14日,美國FDA官網(wǎng)發(fā)布了2021年仿制藥年度報告,全年FDA仿制藥組(OGD)批準(zhǔn)了736個ANDA項目,其中新冠藥物成一大熱點,此外不少品種在2021年期間銷售額亮眼,其中來那度胺膠囊突破百億美元。78個ANDA文號(65個品種)來自國內(nèi)企業(yè),涉及28家藥企(以集團(tuán)計),其中復(fù)星醫(yī)藥以16個ANDA文號居首,健友股份以14個緊接其后。
報告顯示,2021年全年FDA仿制藥組(OGD)批準(zhǔn)了736個ANDA項目,其中最終獲批593個,暫時獲批143個。
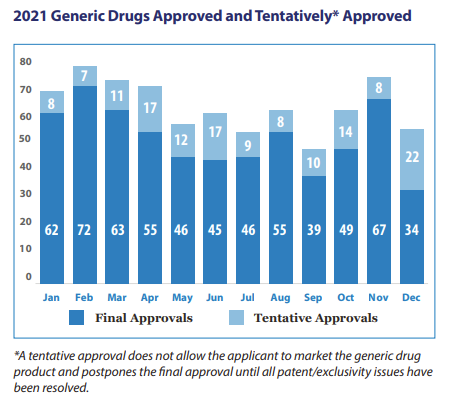
在疫情下,超過75項原始ANDA獲批是針對COVID-19患者的潛在治療支持療法的仿制藥,包括地塞米松注射液、、丙泊酚乳劑注射液以及鹽酸右美托咪定注射液等。
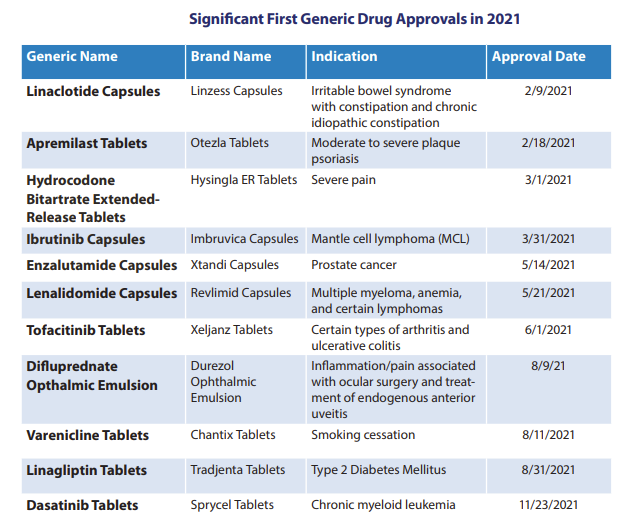
值得注意的是,2021年OGD批準(zhǔn)了93個首仿藥,其中FDA指定的重要首仿藥共11個,包括:利那洛肽膠囊、阿普斯特片、酒石酸氫可酮緩釋片、依魯替尼膠囊、恩雜魯胺膠囊、來那度胺膠囊、托法替尼片、二氟潑尼酯眼用乳液、伐尼克蘭片、利格列汀片、達(dá)沙替尼片。
從全球銷售情況看,不少品種表現(xiàn)亮眼。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2021年,百時美施貴的來那度胺全球銷售額達(dá)128.21億美元,安進(jìn)的阿普斯特達(dá)22.49億美元,百時美施貴的達(dá)沙替尼達(dá)21.17億美元,輝瑞的恩雜魯胺達(dá)11.85億美元,艾伯維的利那洛肽達(dá)10.38億美元。
此外,在競爭性仿制藥(CGT)批準(zhǔn)當(dāng)中,從2017年批準(zhǔn)實施開始至2021年12月31日,F(xiàn)DA已批準(zhǔn)119種具有CGT資格的仿制藥產(chǎn)品,其中在2021年全年期間批準(zhǔn)了52個。
國內(nèi)藥企ANDA號數(shù)量TOP5
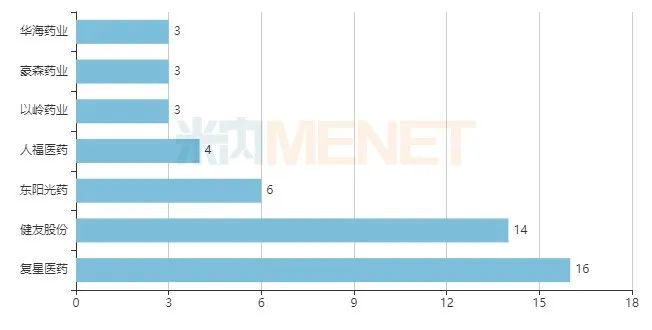
736個ANDA文號中,有78個由國內(nèi)企業(yè)獲得,涉及28家藥企(以集團(tuán)計),共65個品種(以藥品名稱+企業(yè)名計),與去年相比,奧科達(dá)、北京泰德等為今年的新晉企業(yè)。
2021年中國藥企獲得FDA批準(zhǔn)的ANDA
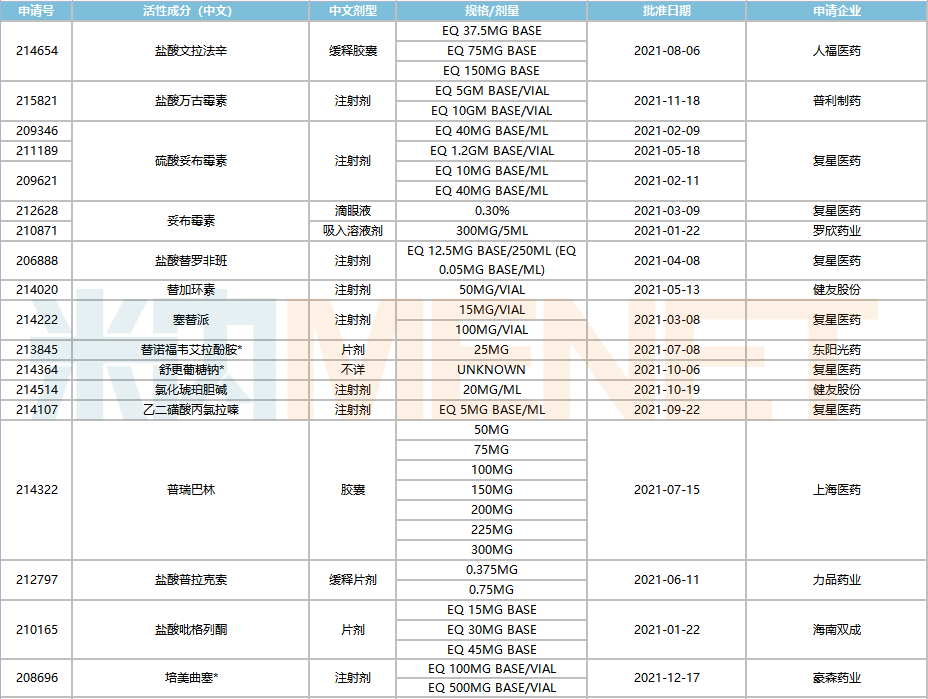
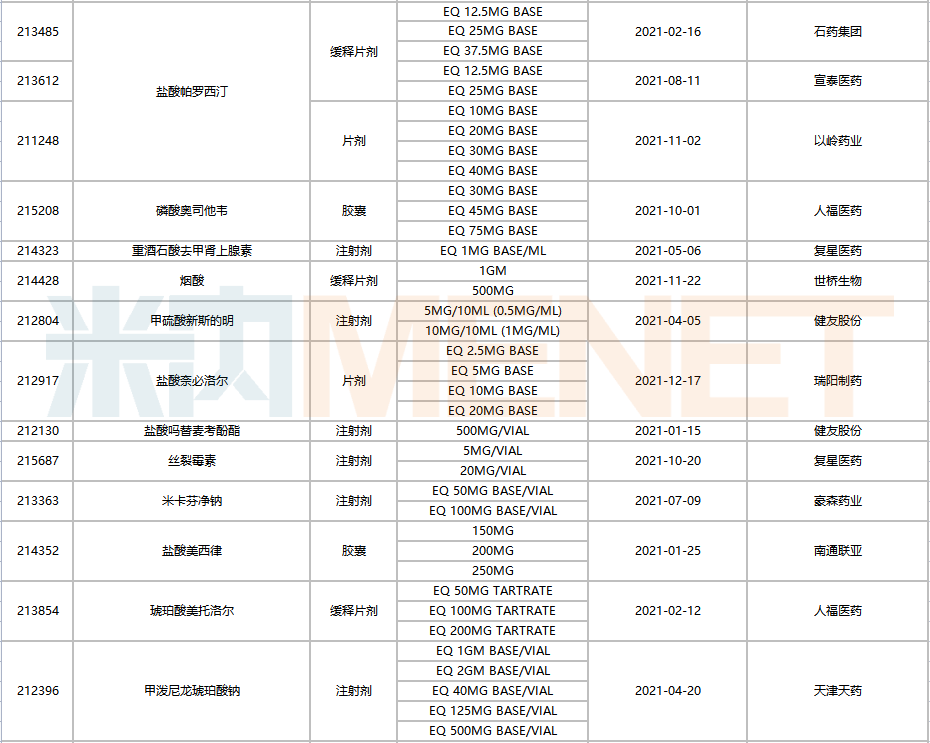
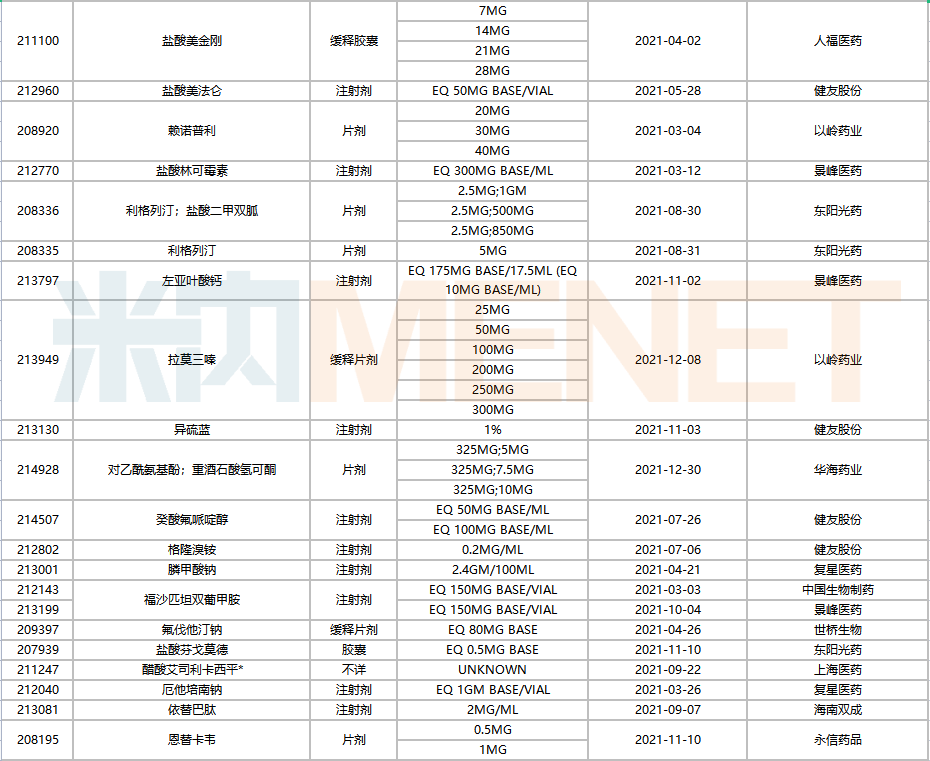
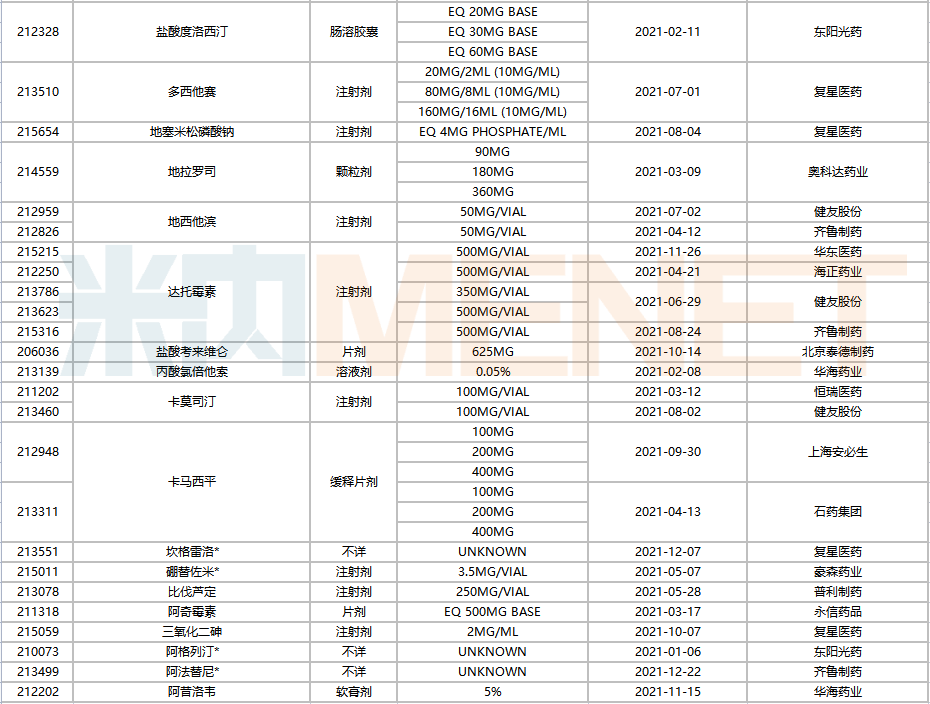
注:帶*為暫定批準(zhǔn)
復(fù)星醫(yī)藥以16個ANDA號居首,健友股份14個位居第二,東陽光藥、人福醫(yī)藥以及以嶺藥業(yè)分別獲得6個、4個、3個ANDA號。



