近日,廣東省藥品監(jiān)管局在深圳市召開推進(jìn)醫(yī)療器械唯一標(biāo)識系統(tǒng)試點工作現(xiàn)場會,現(xiàn)階段性總結(jié)醫(yī)療器械唯一標(biāo)識系統(tǒng)試點工作進(jìn)展和成效。
截至12月3日,廣東省有276 家企業(yè)向醫(yī)療器械唯一標(biāo)識數(shù)據(jù)庫填報數(shù)據(jù)69669條,有236家企業(yè)發(fā)布數(shù)據(jù)67444條,其中三類企業(yè)有130家已填報數(shù)據(jù),110家已發(fā)布數(shù)據(jù)。
醫(yī)療器械唯一標(biāo)識(Unique Device Identification,簡稱UDI)是醫(yī)療器械產(chǎn)品的電子身份證,可實現(xiàn)全生命周期醫(yī)療器械通查通識,是目前醫(yī)療器械追溯管理最好的方法,在國際上被廣泛使用。
我國UDI試點工作于2019年開始啟動,2021年1月1日首批高風(fēng)險第三類醫(yī)療器械中9大類69個醫(yī)療器械品種正式實施唯一標(biāo)識。
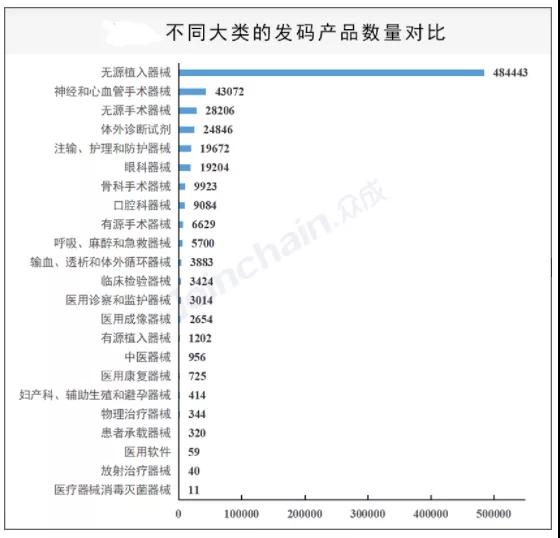
眾成數(shù)科數(shù)據(jù)顯示,自實施以來已有超過60萬醫(yī)療器械產(chǎn)品實施并具有唯一標(biāo)識,其中絕大部分產(chǎn)品為耗材產(chǎn)品,尤其是無源植入器械,神經(jīng)和心血管手術(shù)器械和無源手術(shù)器械,且多為Ⅲ類產(chǎn)品。
為了盡快實現(xiàn)醫(yī)療器械的可追溯,不少省市已提前布局,加快推進(jìn)UDI的實施。目前,部分省市已經(jīng)提前完成UDI實施工作,還有部分省市結(jié)合實際情況擴(kuò)大了實施范圍。
四川省藥監(jiān)局在推進(jìn)UDI工作節(jié)點上明確,2021年9月-11月完成全三類醫(yī)療器械產(chǎn)品賦碼、數(shù)據(jù)上傳和維護(hù)等工作。2021年12月,對納入實施企業(yè)和單位完成情況進(jìn)行檢查驗收。
河北省藥監(jiān)局則要求2021年11月1日起生產(chǎn)的醫(yī)療器械(全三類)應(yīng)當(dāng)具有醫(yī)療器械唯一標(biāo)識。
山東省藥監(jiān)局預(yù)計在11月底前轄區(qū)內(nèi)第三類醫(yī)療器械生產(chǎn)企業(yè)將全部實施UDI。
另外,不少省市在《關(guān)于深入推進(jìn)試點做好第一批實施醫(yī)療器械唯一標(biāo)識工作的公告》的要求下,結(jié)合本地實際情況,擴(kuò)大了實施范圍,福建、云南、海南、天津等省市將第二類醫(yī)療器械納入實施品種中。
隨著UDI實施范圍不斷擴(kuò)大,各地工作陸續(xù)推進(jìn),將有利于加強我國醫(yī)療器械全生命周期管理,提高醫(yī)療器械識別的準(zhǔn)確性和一致性,提升醫(yī)療器械管理水平和效能,有力保障公眾用械安全有效。



